| 高考省级导航 | |
|
|
| 高考省级导航 | |
|
|
|
高考化学知识点总结《电离能》在线测试(2017年最新版)(二)
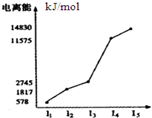 参考答案:D 本题解析: 本题难度:简单 2、选择题 某种元素的电离能数据如下(单位:kJ/mol),该元素最可能是( )
A.S区元素 B.f区元素 C.p区元素 D.d区元素 参考答案:A 本题解析: 本题难度:简单 3、选择题 下列关于稀有气体的叙述不正确的是 参考答案:B 本题解析: 本题难度:简单 4、填空题 图表法、图象法是常用的科学研究方法.
(1)该反应的化学方程式为______ (2)若M、P、Q均为气体,反应达平衡时: ①体系的压强是开始时的______倍;从反应开始到平衡气体M的平均反应速率为______ ②若此时只将容器的体积扩大为原来的2倍,达新平衡时,容器内温度将降低(容器不与外界进行热交换),则该反应为______反应(填“放热”或“吸热”);达新平衡时,容器内混合气体的平均分子量比原平衡时______(填增大、减小或相等). (3)此反应达平衡后,若只加大体系压强,M的物质的量增加,若M是气体,则Q的聚集状态是______.  参考答案:I.由题意知,电离能越小,失电子越容易,该元素金属性越强,因为 M、N、O的电离能较小,所以 M、N、O是金属;P的第一、第二、第三电离能都比较大,所以是稀有气体;第一电离能最小的是?M,所以其金属性最强;O元素的第一电离能和第二电离能差比第三电离能和第二电离能的差小很多,所以显二价的金属是O. 本题解析: 本题难度:一般 5、选择题 下列物质中属于电解质的是 参考答案:B 本题解析:分析:在水溶液里或熔融状态下能导电的化合物是电解质,在水溶液里或熔融状态下都不导电的化合物是非电解质,以此来解答. 本题难度:一般 |
| 【大 中 小】【打印】 【繁体】 【关闭】 【返回顶部】 | |
| 下一篇:高中化学知识点总结《离子共存》.. | |