微信搜索关注"91考试网"公众号,领30元,获取公务员、事业编、教师等考试资料40G!
1、选择题 现有以下物质:①NaCl晶体, ②SO3, ③纯醋酸, ④BaSO4晶体,⑤蔗糖,⑥乙醇,⑦熔融KNO3,请回答下列问题(填序号):
(1)以上物质中能导电的是?;
(2)以上物质中属于非电解质,但其水溶液可以导电的是________________________;
(3)以上物质中属于弱电解质的是_____________________________;
参考答案:(1) ⑦?(2)?②?(3)?③
本题解析:(1)氯化钠固体含有离子,但不能自由移动,不能导电;三氧化硫是非电解质,不能导电;醋酸是电解质,但纯醋酸不能电离,不能导电;硫酸钡是电解质,不能电离出离子,不能导电;蔗糖、乙醇是非电解质,不能导电;熔融的硝酸钾能电离出离子,可以导电,答案选⑦。
(2)溶于水和在熔融状态下均不能电离出离子的化合物是非电解质,三氧化硫、蔗糖、乙醇都是非电解质。电能三氧化硫溶于水生成硫酸,可以电离出离子,溶液可以得到,因此答案选②。
(3)在溶液中不能完全电离,存在电离平衡的电解质是弱电解质。在溶液中完全电离,不能存在电离平衡的电解质是强电解质。氯化钠、硫酸钡和硝酸钾均是强电解质,醋酸是弱电解质,答案选③。
本题难度:一般
2、选择题 下列物质中含有自由移动的Cl―的是(?)
A.KClO3溶液
B.液态HCl
C.KCl溶液
D.NaCl晶体
参考答案:C
本题解析:A、KClO3电离产生ClO3?,错误;B、液态HCl不电离,只含有HCl分子,错误;C、KCl溶液中,KCl电离产生Cl?,正确;D、NaCl晶体中Cl?不能自由移动,错误。
本题难度:简单
3、选择题 下列浓度关系正确的是
[? ]
A.pH=2的HA溶液与pH=12的MOH溶液任意比混合:c(H+)+c(M+)=c(OH-)+c(A-)
B.pH相等的CH3COONa、NaOH和Na2CO3三种溶液:c(NaOH)<c(CH3COONa)<c(Na2CO3)
C.等体积等浓度的氢氧化钠与醋酸混合:c(Na+)=c(CH3COO-)
D.Na2CO3溶液中:c(Na+)>c(CO32-)>c(OH-)>c(HCO3-)>c(H+)
参考答案:AD
本题解析:
本题难度:一般
4、选择题 下列事实一定能说明HF是弱酸的是( )
①常温下NaF溶液的pH大于7;
②用HF溶液做导电性实验,灯泡很暗;
③HF与NaCl不能发生反应; ?
④常温下0.1mol/L的HF溶液的pH为2.3;
⑤HF能与Na2CO3溶液反应,产生CO2气体;?
⑥HF与水能以任意比混溶;
⑦1mol/L的HF水溶液能使紫色石蕊试液变红.
A.①②⑦
B.②③⑤
C.③④⑥
D.①④
参考答案:①常温下碱性溶液中PH>7,NaF溶液的pH大于7说明呈碱性,说明NaF发生了水解,HF是弱酸,故①正确;
②导电性强弱主要与离子浓度有关,不能说明HF是弱酸,故②错误;
③HF与NaCl不能发生反应与HF是弱酸无关,故③错误;
④常温下0.1mol/L的HF溶液的pH为2.3说明HF部分电离是弱酸,故④正确;
⑤HF能与Na2CO3溶液反应,产生CO2气体说明HF的酸性比碳酸的强,不能说明HF是弱酸,故⑤错误;
⑥HF与水能以任意比混溶与HF的酸性无关,故⑥错误;
⑦1mol/L的HF水溶液能使紫色石蕊试液变红说明HF水溶液显酸性,不能说明HF是弱酸,故⑦错误;
故选D.
本题解析:
本题难度:一般
5、选择题 25℃时,将0.01molCH3COONa和0.002molHCl溶于水,形成1L混合溶液:
(1)该溶液中存在着三个平衡体系,用电离方程式或离子方程式表示:
①_________②___________ ③__________。
(2)溶液中共有________种不同的粒子(指分子和离子)。
(3)在这些粒子中,浓度为0.01mol/L的是_________,浓度为0.002mol/L的是_________。
(4)__________和___________两种粒子物质的量之和等于0.01mol。
参考答案:(1)CH3COO-+H2O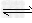 CH3COOH+OH-;CH3COOH
CH3COOH+OH-;CH3COOH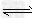 CH3COO-+H+;?H2O
CH3COO-+H+;?H2O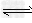 OH-+H+;
OH-+H+;
(2)7;
(3)Na+;Cl-;
(4)CH3COOH;CH3COO-
本题 解析:
本题难度:一般