微信搜索关注"91考试网"公众号,领30元,获取公务员、事业编、教师等考试资料40G!
1、选择题 在水中加入等物质的量的Ag+、Ba2+、SO42-、NO3-、Cl-、Na+,用惰性材料作电极进行电解,通电片刻后停止,下列说法不正确的是(?)
A.电解的实质是:阳极:2Cl--2e-====Cl2↑;阴极:Ag+e-====Ag
B.电解的实质是:阳极:4OH--4e-====2H2O+O2↑;阴极:2H++2e-====H2↑
C.要恢复成电解前的溶液可以加水
D.电解产物中氧化产物和还原产物的物质的量之比为1∶2
参考答案:A
本题解析:由原溶液中Ag+与Cl-、Ba2+与SO42-均全部沉淀,故溶液其实是NaNO3溶液,根据放电顺序可知:阳极:4OH--4e-==2H2O+O2↑;阴极:2H++2e-==H2↑,氧化产物氧气和还原产物氢气的物质的量之比为1∶2;相当于电解水,恢复成电解前的溶液可以加水即可;
故答案为A
本题难度:一般
2、选择题 下列说法正确的是
A.原电池反应是自发的氧化还原反应,盐桥的作用是平衡正负极电荷, 形成闭合回路
B.为防止轮船发生腐蚀,往往在轮船外壳焊上金属锌,这是牺牲阴极的阳极保护法
C.精炼铜时,粗铜做阳极,纯铜做阴极,CuSO4是电解质溶液,电解前后溶液浓度不变
D.电镀是特殊的电解,电解前后阴极减少的质量与阳极增加的质量相等
参考答案:A
本题解析:B、为防止轮船发生腐蚀,往往在轮船外壳焊上金属锌,锌活泼,这是牺牲阳极的阴极保护法,B错;C、精炼铜时,粗铜做阳极,纯铜做阴极,CuSO4是电解质溶液,电解前后CuSO4溶液浓度减小,粗铜放电时,,比铜活泼的金属优先放电,而溶液中的铜离子放电,所以电解前后溶液浓度减小;D、电镀是特殊的电解,,阳极材料本身放电,所以电解前后阳极减少的质量与阴极增加的质量相等,D错。故选AS。
点评:熟练掌握电解的相关知识,尤其是电解池和电镀池,电解质溶液的变化区别,前者变小,后者基本不变
本题难度:简单
3、填空题 如图所示的实验装置,丙为用淀粉碘化钾和酚酞混合溶液润湿的滤纸,m、n为夹在滤纸两端的铂夹。丁为直流电源,x、y为电源的两极。G为电流计,电极均为石墨电极。闭合K2、断开K1,一段时间后,A、B两极产生的气体体积之比为2:1,回答下列问题:
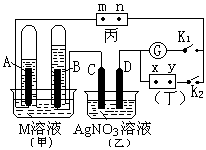

(1)M溶液可能是?(填序号)。
A.KNO3溶液?B. Ba(OH)2溶液 C.H2SO4溶液 ?
D. NaCl溶液 ?E.CuSO4溶液
(2)X为电源?极,m点的现象?。
(3)C极的电极反应式为?。
(4)若乙池中AgNO3溶液电解后体积为100mL,测得溶?液的pH=1, 则乙池中C极析出的固体质量为?g。?
(5)继续电解一段时间后,甲池中A、B极均部分被气体包围,此时闭合K1,断开K2,发现A、B极的管内气体体积减少,且电流计G指针发生偏转,则A极电极反应式为?。
参考答案:(1)A、B、C(2)负?滤纸变红
(2)Ag++e- =Ag;(3)1.08;(4)H2-2e-==2H+。
本题解析:据题意A、B两极产生的气体体积之比为2:1,可推知甲装置中实质是电解水,而且A极产生的是氢气,进一步可确定Y为电源的正极,X为电源的负极。据乙池电解反应式:4Ag++2H2O 4Ag+O2+4H+,n(Ag)=n(H+)=O.01mol,即可求出析出银的质量。当闭合K1,断开K2时,甲池形成原电池,A极为原电池的负极。
4Ag+O2+4H+,n(Ag)=n(H+)=O.01mol,即可求出析出银的质量。当闭合K1,断开K2时,甲池形成原电池,A极为原电池的负极。
本题难度:一般
4、填空题 (1)某课外活动小组同学用下图所示装置进行实验,试回答下列问题。
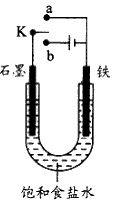
①若开始时开关K与a连接,则铁发生电化学腐蚀中的___________ 腐蚀。
②若开始时开关K与b连接,则总反应的离子方程式为____________。
(2)芒硝化学式Na2SO4·10H2O,无色晶体,易溶于水,是一种分布很广泛的硫酸盐矿物。该小组同学设想,如果模拟工业上离子交换膜法制烧碱的方法,用如下图所示装置电解硫酸钠溶液来制取氢气、氧气、硫酸和氢氧化钠,无论从节省能源还是提高原料的利用率而言都更加符合绿色化学理念。
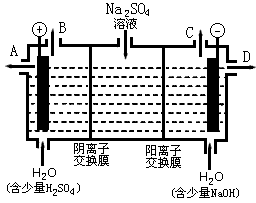
①该电解槽的阳极反应式为___________ 。此时通过阴离子交换膜的离子数_________ (填“大于”“小于”或“等于”)通过阳离子交换膜的离子数。
②制得的氢氧化钠溶液从出口(填“A""B""C"或 “D")____________导出。
③通电开始后,阴极附近溶液pH会增大,请简述原因_________。
④若将制得的氢气、氧气和氢氧化钠溶液组合为氢 氧燃料电池,则电池负极的电极反应式为 ___________。已知H2的燃烧热为 285.8 kJ/mol,则该燃料电池工作产生36g H2O时,理 论上有___________kJ的能量转化为电能。
参考答案:(1)①吸氧 ;②2Cl-+2H2O 2OH-+ H2↑+Cl2↑
2OH-+ H2↑+Cl2↑
(2)①4OH--4e-=2H2O+O2↑;小于
②D
③H+放电促进水的电离,使OH -的浓度增大
④H2 -2e- +2OH-=2H2O? ;571.6
本题解析:
本题难度:一般
5、选择题 三氧化二镍(Ni2O3)可用于制造高能电池,其电解法制备过程如下:用NaOH调NiCl2溶液pH至7.5,加放适量硫酸钠后进行电解。电解过程中产生的Cl2在弱碱性条件下生成ClO-,把二价镍氧化为三价镍。以下说法不正确的是
A.可用铁作阳极材料
B.电解过程中阳极附近溶液的pH降低
C.阳极反应方程式为:2Cl--2e-=Cl2
D.1 mol二价镍全部转化为三价镍时,外电路中通过了1 mol电子
参考答案:A
本题解析:铁如果做阳极,则铁失去电子生成亚铁离子,此时得不到氯气,A不正确;阳极生成,溶于水生成盐酸和次氯酸,pH降低,B和C都是正确的;根据电子的得失守恒可知,选项D正确,答案选A。
点评:在进行电解池的有关计算时,应该充分利用电子得失守恒这一关系式。
本题难度:一般