微信搜索关注"91考试网"公众号,领30元,获取公务员、事业编、教师等考试资料40G!
1、选择题 下列不是离子化合物的是(? )
A.CaI2
B.H2SO4
C.KOH
D.NH4NO3
参考答案:B
本题解析:
本题难度:一般
2、选择题 下列关于化学键的叙述中,正确的是 (? )
A.化学键既存在于相邻原子间,又存在于不相邻原子间
B.化学键指的是相邻原子间的强烈的相互作用
C.两个原子之间的相互作用叫化学键
D.阴阳离子间通过静电吸引而形成的化学键为离子键
参考答案:B
本题解析::A、化学键存在于相邻的原子之间,不存在于分子之间,故A错误.
B、化学键通常指的是相邻的两个或多个原子之间的强烈的相互作用,这种相互作用既包括吸引力也包括排斥力,故B正确;
C、化学键包含离子键、共价键、金属键,阴阳离子之间的相互作用是离子键,故C正确.
D、离子键离子键指阴离子,阳离子间通过静电作用形成的化学键,故D错误。
故选B。
点评:本题考查了化学键的概念,难度不大,明确相邻的两个或多个原子之间的强烈的相互作用才是化学键,不相邻的原子之间的作用力不是化学键。
本题难度:简单
3、填空题 卤族元素的单质和化合物很多。
(1)卤素原子与氢原子形成的共价键中,极性最强键的是_____。NaF、MgF2、SiF4三种晶体的熔点从高到低的顺序是______。
(2)已知CsICl2不稳定,受热易分解 ,倾向于生成晶格能更大的物质,则它按下列_____式发生。
A.CsICl2=CsCl+ICl? B.CsICl2=CsI+Cl2
(3)CH3Cl、BF3、SCl2三种分子中属于极性分子的是?,ClO2-中心氯原子的杂化轨道类型为______,写出一种与SO32-互为等电子体的分子?。
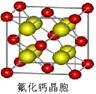
(4)已知CaF2晶体(见图)的密度为ρg/cm3,NA为阿伏加德罗常数,相邻最近的?两个Ca2+的核间距为a cm,则CaF2的相对分子质量可以表示为___________。
参考答案:(1)H-F(1分) MgF2﹥NaF﹥SiF4 (2分)
(2)A?(2分)
(3)CH3Cl、SCl2(2分)? sp3杂化(2分)? PCl3(或NCl3等)(2分)
(4)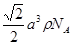 ?(2分)
?(2分)
本题解析:(1)由于形成共用电子对的两元素的非金属性强弱相差越大,形成的共价键的极性越强;卤素原子与氢原子形成的共价键中,都含有氢原子,其它元素的非金属性大小关系为:F>Cl>Br>I,所以极性键的极性大小关系为:H-F>H-Cl>H-Br>H-I;NaF MgF2为离子晶体所以熔点高于分子晶体SiF4,在离子晶体中,离子的半径越小,晶格能越大;阴、阳离子所带电荷越多,晶格能越大,则晶体的熔点越高;电荷的影响大于半径的影响,所以NaF、MgF2、SiF4三种晶体的熔点从高到低的顺序是MgF2﹥NaF﹥SiF4。
(2)加热多卤化物则离解为简单的卤化物和卤素单质。CsBr3=CsBr+Br2,若为多种卤素的多卤化物,则离解生成具有最高晶格能的一种卤化物,如:CsICl2=CsCl+ICl,而不是CsI+Cl2,所以选A。
(3)组成为ABn型化合物,若中心原子A的化合价等于族的序数,则该化合物为非极性分子,所以BF3属于非极性分子,SCl2属于极性分子,CH3Cl空间结构为四面体形,不是正四面体,正负电荷的中心不重合,属于极性分子。ClO2-中价层电子对个数=2+1/2(7+1-2×2)=2,且含有2个孤电子对,所以空间构型是V型,sp3杂化;等电子体是指具有相同电子数目和原子数目的分子或离子,SO32-中有4个原子,6+6×3+2=26个价电子。
(4)该晶胞中含有钙离子个数=1/8×8+6×1/3 =4,氟离子个数=8,,相邻最近的两个Ca2+的核间距是正方体对角线的一半,所以正方体的边长为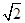 a cm,ρ=
a cm,ρ=  ?,所以CaF2的相对分子质量可以表示为
?,所以CaF2的相对分子质量可以表示为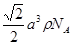 。
。
本题难度:一般
4、简答题 下列叙述正确的是( )
A.离子化合物中不可能含有共价键
B.共价化合物中不可能含有离子键
C.非极性分子中一定含有非极性键
D.由极性键形成的分子一定是极性分子
参考答案:A、离子化合物中可能含有共价键,如NaOH等,故A错误;
B、共价化合物中一定不含离子键,故B正确;
C、非极性分子中可能不含非极性键,如CCl4等,故C错误;
D、由极性键形成的分子可能是非极性分子,如CO2、CCl4等,故D错误;
故选B.
本题解析:
本题难度:一般
5、选择题 下列各组物质中,都是共价化合物的是
[? ]
A.H2S和Na2O2
B.H2O2和NH4Cl
C.NH3和N2
D.HNO3和HCl
参考答案:D
本题解析:
本题难度:简单