微信搜索关注"91考试网"公众号,领30元,获取公务员、事业编、教师等考试资料40G!
1、选择题 实验室在配制FeSO4溶液时,为防止FeSO4被氧化而变质,常在溶液中加入少量的( )
A.锌粉
B.铁粉
C.硫酸铁
D.盐酸
参考答案:A.锌粉与FeSO4溶液反应,配制溶液失败,故A不选;
B.铁粉与与FeSO4溶液不反应,且可防止亚铁离子被氧化而变质,故B选;
C.硫酸铁和硫酸亚铁不反应,但引入杂质铁离子,故C不选;
D.加盐酸引入氯离子,且不能防止亚铁离子被氧化,故D不选;
故选B.
本题解析:
本题难度:简单
2、选择题 溴化碘(IBr)等卤素互化物的化学性质很像卤素的单质,能与大多数金属、非金属化合生成卤化物,如IBr能与水发生以下反应:IBr+H2O═HBr+HIO,下列有关IBr的叙述中,不正确的是( )
A.在很多化学反应中,IBr是强氧化剂
B.IBr与Zn反应中,ZnI2既是氧化产物,又是还原产物
C.IBr与水反应时既做氧化剂,又做还原剂
D.IBr与AgNO3溶液反应会生成AgBr沉淀
参考答案:A、溴化碘的化学性质与卤素单质相似,则IBr中I元素的化合价为+1价,I元素的化合价在反应中能降低,则在很多化学反应中IBr是强氧化剂,故A正确;
B、IBr中I元素的化合价为+1价,Br为-1价,IBr与Zn反应中Zn元素的化合价升高,I元素的化合价降低,则生成物ZnI2既是氧化产物,又是还原产物,故B正确;
C、因IBr中I元素的化合价为+1价,Br为-1价,HBr中Br为-1价,HIO中I为+1价,则IBr+H2O═HBr+HIO中没有元素化合价的变化,该反应属于非氧化还原反应,则IBr与水反应时既不做氧化剂,也不做还原剂,故C错误;
D、IBr与AgNO3溶液反应时IBr与水反应生成的HBr与AgNO3反应生成AgBr沉淀,故D正确;
故选C.
本题解析:
本题难度:一般
3、简答题 铁及其化合物在生活、生产中有广泛应用.请回答下列问题:
(1)黄铁矿(FeS2)是生产硫酸和冶炼钢铁的重要原料.其中一个反应为:3FeS2+8O2
6SO2+Fe3O4,有3mol FeS2参加反应,转移?mol电子.
(2)氯化铁溶液常用作印刷电路铜板腐蚀剂,反应的离子方程式为?;从腐蚀废液回收得到金属铜,还需要的试剂是?.
(3)与明矾相似,硫酸铁也可用作净水剂,在使用时发现硫酸铁并不能使酸性废水中的悬浮物沉降除去,其原因是?.
(4)钢铁的电化腐蚀简单示意图如图,将该图稍作修改?即可成为钢铁电化学防护的简单示意图,请在虚线框内作出修改,并用箭头标出电子流动方向?.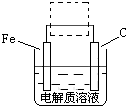
参考答案:(1)3FeS2+8O2?高温?.?6SO2+Fe3O4中,Fe、S元素的化合价升高,O元素的化合价降低,3molFeS2参加反应,由O元素的化合价变化可知,转移的电子为8mol×2×(2-0)=32mol,故答案为:32;
(2)氯化铁溶液与铜反应生成氯化铜和氯化亚铁,该离子反应为2Fe3++Cu=2Fe2++Cu2+,利用置换反应得到,过量铁粉利用盐酸或硫酸除去,则选试剂为铁粉、稀盐酸(稀硫酸),故答案为:2Fe3++Cu=2Fe2++Cu2+;
(3)因酸性废水抑制Fe3+的水解,使其不能生成有吸附作用的Fe(OH)3胶体,则硫酸铁并不能使酸性废水中的悬浮物沉降除去,故答案为:酸性废水抑制Fe3+的水解,使其不能生成有吸附作用的Fe(OH)3胶体;
(4)防止铁被腐蚀,可利用外加电源的阴极保护法,则铁与电源的负极相连,如图
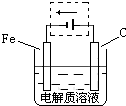
,故答案为:

.
本题解析:
本题难度:一般
4、简答题 化学学习小组为测定“阳光”牌小包装中Fe粉和活性炭质量之比进行了以下探究:
查阅资料:“阳光”牌小包装“脱氧剂”成份为Fe粉、活性炭及少量NaCl、水.
实验步骤:
步骤一:取某食品包装袋中的“阳光”牌“脱氧剂”一袋,将里面的固体倒在滤纸上,仔细观察,固体为灰黑色粉末,夹杂着一些红棕色粉末.
步骤二:将步骤一中的固体溶于水,过滤,将滤渣洗涤、干燥,以除去“脱氧剂”中NaCl和水;
步骤三:取步骤二中的滤渣,将其分为两等份,每一份质量为16.0g.将其中一份在氧气流中充分灼烧,生成的气体全部通入足量得澄清石灰水,得到干燥、纯净的沉淀20.0?g.
步骤四:将步骤三中的另一份滤渣放入烧杯中,加入一定体积足量的稀H2SO4,微热至反应完全.
步骤五:向步骤四的混合物中加入过量的氢氧化钠溶液,过滤后得固体,经洗涤后转移到坩埚中充分加热,冷却、称量,得到固体质量仍为16g.
请回答下列问题:
(1)由步骤一可知,上述“脱氧剂”中的红棕色物质为______(填化学式);
(2)由步骤三可知,16.0?g滤渣中活性炭的质量为______g;
(3)综上实验所知:该“脱氧剂”中未被氧化的Fe粉和活性炭质量之比为______;
(4)该“脱氧剂”中,铁已被氧化的百分率为______.
参考答案:(1)在金属铁的氧化物中,只有氧化铁是红棕色的固体,所以“脱氧剂”中的红棕色物质为Fe2O3,故答案为:Fe2O3;
(2)由步骤三结合碳元素守恒,得到干燥、纯净的沉淀20.0g即为碳酸钙的总质量,设碳单质的质量为x,则
C~CO2~CaCO3,
12? 100
x? 20g
12x=10020g,
解得x=2.4g,所以16.0g滤渣中活性炭的质量为2.4g,故答案为:2.4g;
(3)根据实验,向金属铁以及氧化铁的混合物中加入一定体积足量的稀H2SO4,微热至反应完全.再加入过量的氢氧化钠溶液,过滤后会得固体氢氧化铁,经洗涤后转移到坩埚中充分加热,冷却、称量,得到固体氧化铁质量为16g即为0.1mol,则根据铁元素守恒,设金属铁的物质的量为m,氧化铁的物质的量为n,
则
本题解析:
本题难度:一般
5、选择题 下列变化需要加入还原剂才能实现的是( )
A.Na2SO3→SO2
B.HCl→Cl2
C.H2SO4(浓)→SO2
D.S→SO2
参考答案:C
本题解析:
本题难度:一般