|
高中化学知识点归纳《物质的量》考点预测(2017年强化版)(六)
2017-07-27 08:06:37
来源:91考试网
作者:www.91exam.org 【 大 中 小】
|
微信搜索关注"91考试网"公众号,领30元,获取公务员、事业编、教师等考试资料40G!
1、选择题 设NA为阿伏加德罗常数,下列说法正确的是 ( )
A.标准状况下,5.6L水含有的分子数为0.25NA
B.1molCl2发生反应时,转移的电子数一定是2NA
C.1L 1mol/L的HCl溶液中含Cl-数为NA
D.1mol Fe与足量盐酸反应,转移的电子数为3NA
|
参考答案:C
本题解析:水标准状况下为固体,所以标准状况下,5.6L水含有的分子数大于0.25NA,A错误;1molCl2如果发生歧化反应时,转移电子数不能确定,B错误;1mol Fe与足量盐酸反应,转移的电子数为2NA。答案选C。
考点:阿伏伽德罗常数
点评:阿伏伽德罗常数是历年高考的“热点”问题。多年来全国高考化学试题出现的几率为100%。这双因为它既考查了学生对物质的量与粒子数、质量、气体体积和物质的量浓度之间的关系,又可以与物质结构、盐类水解、弱电解质的电离等其他的概念性知识点结合成综合性习题。
本题难度:困难
2、填空题 (1)2 mol O3与3 mol O2的质量之比 ,分子数之比 ,同温同压下的密度之比 ,含氧原子数之比 ,体积之比 。
(2)O3与Cl2具有相似的性质,均可用于自来水的消毒。已知二者在消毒时均被还原为最低价态,则相同状况下10 L O3与 L Cl2的消毒能力相当。
(3)气体化合物A分子式可表示为OxFy,已知同温同压下10 mL A受热分解生成15 mL O2和10 mL F2,则A的化学式为 ,推断的依据为 。
参考答案:(1)1:1 2:3 3:2 1:1 2:3
(2)30 (3)O3F2阿伏加德罗定律和质量守恒定律
本题解析:(1)根据物质的量与其他量的关系把物质的量转化成要求的量,运用阿伏加德罗定律时,注意所给的条件。
(2)此过程为氧化还原反应,用O3与Cl2消毒后分别转化为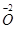 、 、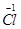 ,若设Cl2的体积为xL,根据氧化还原反应过程中化合价升降总数相等,则10 L×3×[0-(-2)]=xL×2×[0-(-1)],解得x=30. ,若设Cl2的体积为xL,根据氧化还原反应过程中化合价升降总数相等,则10 L×3×[0-(-2)]=xL×2×[0-(-1)],解得x=30.
(3)根据质量守恒定律和阿伏加德罗定律,写出分解反应的化学方程式为2OxFy 3O2+2F2,则A的化学式为O3F2。 3O2+2F2,则A的化学式为O3F2。
本题难度:一般
3、选择题 下列叙述正确的是
A.标准状况下,1.12 L16O2和1.12 L18O2均含有0.1NA个氧原子
B.第三周期非金属元素含氧酸的酸性从左到右依次增强
C.能使甲基橙显红色的溶液中大量存在:Mg2+、Fe2+、Cl—、NO—3
D.从C(石墨)=C(金刚石);ΔH=+1.9 kJ·mol-1,可知金刚石比石墨更稳定
参考答案:A
本题解析:B项应为非金属元素的最高价氧化物的酸性从左到右依次增强;C项溶液为酸性,而Fe2+、NO—3会因氧化还原反应不能大量共存;D项石墨能量小于金刚石,更稳定,错误。
本题难度:一般
4、计算题 (8分)常温下,在27.5g水中溶解12.5g CuSO4·5H2O,恰好达到饱和,该溶液密度为1.21g /cm3,求:
(1)该溶液中CuSO4的物质的量浓度
(2)取出20.0 ml该溶液,配成浓度为1.00 mol/L的稀溶液,则稀释后溶液的体积是多少毫升?
参考答案:(1)1.51mol/L (2)30.2ml
本题解析:考查物质的量浓度溶液的有关计算。
(1)溶液的质量是27.5g+12.5g=40g
由于溶液的密度是1.21g/ml
所以溶液的体积是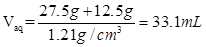
由于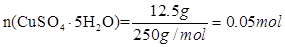
所以根据c=n/V可知,溶液的浓度是

(2)由于再稀释过程中,溶质的物质的量是不变的
所以稀释后溶液的体积是
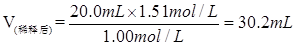 。 。
本题难度:一般
5、选择题 下列说法正确的是(NA表示阿伏加德罗常数)
A.22.4L氯气与足量的钠反应,转移电子数为2 NA
B.常温常压下,32 g O3或O2中含有的氧原子数都为2 NA
C.1 mol氯气与足量NaOH溶液反应时,失去的电子数为2 NA
D.含2 mol H2SO4溶质的浓硫酸与足量铜反应,转移电子数为2 NA
参考答案:B
本题解析:A 错误,没有标明标准状况
B 正确,32/16=2,含有氧原子的物质的量为2mol,含有的氧原子数都为2 NA
C 错误,失去的电子数为 NA
D 错误,浓硫酸变为稀硫酸时,就不在和铜反应,转移电子数小于2 NA
本题难度:简单
|