微信搜索关注"91考试网"公众号,领30元,获取公务员、事业编、教师等考试资料40G!
1、填空题 水是生命之源。饮用水消毒作为控制水质的一个重要环节,液氯消毒是最早的饮用水消毒方法。近年来科学家提出,氯气能与水中的有机物发生反应,生成的有机氯化物可能对人体有害。二氧化氯(ClO2)是一种在水处理等方面有广泛应用的高效安全消毒剂。与Cl2相比,ClO2不但具有更显著地杀菌能力,而且不会产生对人体有潜在危害的有机氯代物。
(1)氯气溶于水能杀菌消毒的原因是?。
(2)在ClO2的制备方法中,有下列两种制备方法:
方法一:NaClO3+4HCl=2ClO2↑+Cl2↑+2NaCl+2H2O
方法二:C6H12O6+24NaClO3+12H2SO4=24ClO2↑+6CO2↑+18H2O+12Na2SO4
用方法二制备的ClO2更适合用于饮用水的消毒,其主要原因是?。
(3)用ClO2处理过的饮用水(pH为5.5~6.5)常含有一定量对人体不利的亚氯酸根离子(ClO2-).2001年我国卫生部规定,饮用水ClO2-的含量应不超过0.2 mg·L-1。
饮用水中ClO2、ClO2-的含量可用连续碘量法进行测定。ClO2被I-还原为ClO2-、Cl-的转化率与溶液pH的关系如图所示。当pH≤2.0时,ClO2-也能被I-完全还原成Cl-。反应生成的I2用标准Na2S2O3溶液滴定:2Na2S2O3+I2=Na2S4O6+2NaI
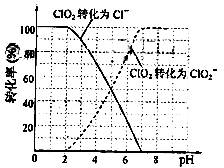
①请写出pH≤2.0时,ClO2-与I-反应的离子方程式??。
②配制Na2S2O3标准溶液时,使用的仪器除天平、药匙、玻璃棒、烧杯、量简外,还需要下图中的?(填字母代号)。
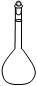 ?
? ?
?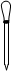 ?
? ?
?
a? b? c? d? e
③请完成相应的实验步骤:
步骤1:准确量取VmL水样加入到锥形瓶中。
步骤2:调节水样的pH为7.0~8.0
步骤3:加入足量的KI晶体。
步骤4:加少量淀粉溶液,用c mol·L-1Na2S2O3溶液滴定至终点,消耗Na2S2O3溶液V1mL。
步骤5:调节溶液的pH≤2.0。
步骤6;再用c mol·L-1Na2S2O3溶液滴定至终点,消耗Na2S2O3溶液V2mL。
④滴定终点的现象是?。
⑤根据上述分析数据,测得该引用水样中的ClO2-的浓度为?mg·L-1(用含字母的代数式表示)。
(4)判断下列操作对ClO2-的浓度测定结果的影响(填“偏高”、“偏低”或“无影响”)
① 若在配制标准溶液过程中,烧杯中的Na2S2O3溶液有少量溅出,使测定结果?。
② 若在滴定终点读取滴定管刻度时,俯视标准液液面,使测定结果?。
参考答案:(1)生成的HClO具有强氧化性,可以杀菌(2分)
(2)方法二制备的ClO2中不含Cl2(2分)
(3)①ClO2-+4H++4I-=Cl-+2I2+2H2O(2分)
②a? c(2分)
③(溶液由蓝色变为无色,(2分)⑤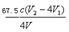 ×103(2分)
×103(2分)
(4)①偏高?(2分)?②偏低(2分)
本题解析:(1)氯气的自来水消毒属于氢氧化性消毒,因此原理是氯气与水反应生成的HClO有强氧化性,起到杀菌消毒作用。
(2)根据题干中的介绍,氯气用于自来水消毒容易生成对人体有害的有机氯代物,所以方法二中产生的ClO2气体中不含氯气,因此制得的二氧化氯更加的安全。
(3) ①从本题题干和图像中得知,溶液pH≤2.0时,ClO2-被I- 还原为Cl- ,因此反应的离子方程式为ClO2-+4H++4I-=Cl-+2I2+2H2O,要注意酸性环境。
②一定浓度溶液的配制需要使用的仪器主要的还有容量瓶、胶头滴管,故选ac。④待滴定溶液中含有碘单质,因此与淀粉作用显蓝色,所以加入Na2S2O3 与单质碘反应,当碘反应完的时候,溶液不显蓝色,故描述时要注意规范表达。
⑤本小题计算稍微有些复杂,首先要了解整个滴定的过程:含有ClO2、ClO2- 的水,碱性下加KI溶液把ClO2 反应为ClO2- ,生成的碘单质用标准液滴定;得到的总的ClO2- 再在酸性条件下与KI反应,又生成一部分碘单质,再用标准液滴定。因此整个过程分为两个阶段。
第一步滴定(生成了一部分ClO2- ):2ClO2+2I-= 2ClO2- +? I2
2Na2S2O3?+ I2?=Na2S4O6+2NaI
cV1?0.5cV1? cV1? 0.5cV1
第二步滴定(反应总的ClO2- )ClO2-+ 4H++4I-=Cl-+ 2I2 +2H2O
2Na2S2O3+I2?=? Na2S4O6+2NaI
0.25cV2? 0.5cV2?cV2 ?0.5cV2
引用水样中的ClO2-的浓度等于总的ClO2-减去第一步 91ExaM.org滴定产生的ClO2- ,因此有:
C(ClO2-)=n总(ClO2-)—n(ClO2-)/V=0.25cV2—cV1 /V,要注意化成质量浓度,所以C(ClO2-)= 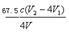 ×103 mg·L-1 。
×103 mg·L-1 。
(4)①滴定过程中若有标准液溅出损失,则从滴定管上读出的标准液体积偏高,所以计算得到的浓度结果会偏大。
②若在滴定终点读取标准液体积时,俯视读数,则读出的标准液体积会偏小,所以计算得到的浓度会偏低。
本题难度:困难
2、计算题 已知Cl-和Ag+反应生成AgCl,每次新生成的AgCl中又有10%见光分解成单质银和氯气,氯气又可在水溶液中岐化成HClO3(为强酸)和HCl。而这样生成的Cl-又与剩余的Ag+作用生成沉淀,如此循环往复,直至最终。现有含1.1molNaCl的溶液,向其中加入足量AgNO3,求最终能生成多少克难溶物(AgCl和Ag)?若最后溶液体积为1L,求溶液中H+物质的量浓度是多少?
参考答案:167.94g? 0.12mol/L
本题解析:本题涉及三个化反应:Ag++Cl-=AgCl↓,2AgCl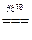 2Ag+Cl2;3Cl2+3H2O=6H++ClO3-+5Cl-,
2Ag+Cl2;3Cl2+3H2O=6H++ClO3-+5Cl-,
若有①60Ag++60Cl-=60AgCl,则应有②6AgCl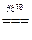 6Ag+3Cl2,③3Cl2+3H2O=ClO3-+5Cl-+6H+,消去循环量,可运用总反应式求解,①+②+③得:60Ag++55Cl-+3H2O=54AgCl↓+6Ag↓+ClO3-+6H+。
6Ag+3Cl2,③3Cl2+3H2O=ClO3-+5Cl-+6H+,消去循环量,可运用总反应式求解,①+②+③得:60Ag++55Cl-+3H2O=54AgCl↓+6Ag↓+ClO3-+6H+。
据此易得: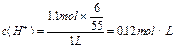 ;
;
难溶物AgCl和Ag的质量为:
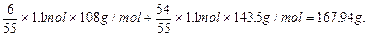
本题难度:一般
3、选择题 如图所示,在火棉胶袋(半透膜)内注入淀粉和食盐溶液,用线系紧密封,使细玻管内的液面刚好高出烧杯内蒸馏水的液面,过一段时间后用碘酒和硝酸银溶液分别检验蒸馏水。整个实验过程中,所观察到的现象是
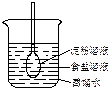
A.细玻管内液面上升
B.细玻管内液面不变
C.蒸馏水遇碘酒变蓝
D.蒸馏水遇硝酸银溶液有白色沉淀生成
参考答案:A、D
本题解析:半透膜袋里的浓度大,因而水进入的比出来的多,细玻璃管液面上升,A正确。食盐中的氯离子通过半透膜进入蒸馏水中,遇硝酸银溶液有白色沉淀生成,而淀粉属于高分子,达到了胶体微粒粒度的范围,不能透过半透膜,因此,加入碘酒不变蓝。
本题难度:简单
4、填空题 新制氯水呈______色,是溶液中有______存在;向氯水中加入锌粒,立即有______生成,说明氯水呈______性;将硝酸银溶液滴加入氯水中,产生的现象是______,所发生反应的化学方程式是______;若用蓝色石蕊试纸遇到氯水后,试纸会先变______,接着______,产生该现象的原因是用化学方程式表示为______;氯水经光照后放出气体,该反应的化学方程式______.
参考答案:新制氯水中含有Cl2,则呈黄绿色,发生Cl2+H2O?HCl+HClO,溶液呈酸性,则加入锌粒,生成氢气,将硝酸银溶液滴加入氯水中,发生AgNO3+HCl=AgCl↓+HNO3,可观察到有白色沉淀生成,若用蓝色石蕊试纸遇到氯水后,试纸会先变红后褪色,原因是HClO具有漂白性,但HClO不稳定,见光易分解生成氧气,反应的方程式为2HClO光照.2HCl+O2↑,
故答案为:黄绿色;Cl2;气体;酸;白色沉淀生成;AgNO3+HCl=AgCl↓+HNO3;红;褪色;Cl2+H2O?HCl+HClO;2HClO光照.2HCl+O2↑.
本题解析:
本题难度:一般
5、实验题 下图是一位学生设计的实验室制取和收集氯气并验证其性质的装置图。

(1)找出在此装置图中出现的错误加以改正。
(2)实验过程中,在D装置中观察到的实验现象是?;在E装置中观察到的实验现象是?,反应的化学方程式是?;
(3)F装置的作用是?,反应的离子方程式是?。
参考答案:(1)稀盐酸改用浓盐酸。B应在A的左边。C中进气管应该长,排气管应该短。(每空1分,共3分。)
(2)溶液先变红后褪色;(2分) 有白色沉淀生成,Cl2+H2O =HClO +HCl
HCl+AgNO3=AgCl↓ +HNO3(每个答案1分,共3分。写总反应、写离子方程式都可)。
(3)吸收多余的氯气,防止污染环境,(1分)?Cl2+2OH—=ClO—+Cl—+H2O(2分)
本题解析:(1)观察装置图中试剂和仪器,出现的错误有:制取Cl2反应物为MnO2和浓盐酸,把装置图中的稀盐酸改为浓盐酸;应先用饱和食盐水除去HCl,再用浓硫酸除去H2O,所以B应在A的左边;Cl2的密度大于空气,收集时进气管应该长,排气管应该短。
(2)Cl2通入石蕊溶液,酸性使石蕊变化,Cl2与H2O反应生成的HClO具有漂白性,使石蕊褪色;Cl2与H2O反应生成的HCl与AgNO3反应生成白色AgCl沉淀,化学方程式有2个,首先是Cl2与H2O反应生成HCl和HClO,然后是HCl与AgNO3反应生成AgCl沉淀和HNO3。
(3)NaOH能与Cl2反应,所以NaOH溶液的作用是吸收多余的氯气,防止污染环境;Cl2与OH?反应生成Cl?、ClO?和H2O,配平可得离子方程式。2实验室制法的实验仪器和试剂及作用、实验现象的观察、方程式的书写。
本题难度:一般