微信搜索关注"91考试网"公众号,领30元,获取公务员、事业编、教师等考试资料40G!
1、填空题 (15分)二氧化氯(ClO2)是一种在水处理等方面有广泛应用的高效安全消毒剂。与Cl2相比,ClO2不但具有更显著的杀菌能力,而且不会产生对人体有潜在危害的有机氯代物。用ClO2处理过的饮用水(pH为5.5~6.5)常含有一定量对人体不利的亚氯酸根离子(ClO2—)。2001年我国卫生部规定,饮用水中ClO2—的含量应不超过0.2mg·L-1。
饮用水中CIO2、CIO2—的含量可用连续碘量法进行测定。CIO2被I—还原为CIO2—、Cl—的转化率与溶液pH的关系如下图所示。当pH≤2.0时,CIO2—也能被I—完全还原成Cl—。反应生成的I2用标准Na2S2O3溶液滴定:
2Na2S2O3+I2==Na2S4O6+2NaI
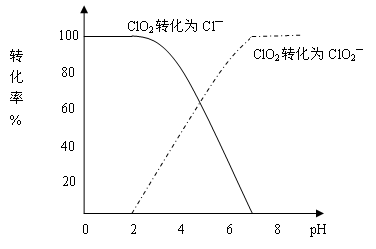
①请写出pH≤2.0时,CIO2—与I—反应的离子方程式 ? 。
②请完成相应的实验步骤:
步骤1:准确量取V mL水样加入到锥形瓶中。
步骤2:调节水样的pH为7.0~8.0。
步骤3:加入足量的K I晶体。
步骤4:加少量淀粉溶液,用c mol·L-1Na2S2O3溶液滴定至终点,消耗Na2S2O3溶液V1mL。
步骤5: ? 。
步骤6:再用c mol·L-1Na2S2O3溶液滴定至终点,消耗Na2S2O3溶液V2mL。
③根⑤据你现有的知识,写出步骤4滴定至终点的现象判断依据为?
④根据上述分析数据,测得该饮用水样中CIO2—的浓度为 ? mol·L-1(用含字母的代数式表示。)
⑤若饮用水中ClO2— 的含量超标,可向其中加入适量的Fe2+将ClO2— 还原成Cl—-, 请猜测该反应的氧化产物是?(填化学式)。
参考答案:①ClO2-+4I-+4H+=Cl-+2H2O+2I2。
②调节溶液的pH不大于2.0。
③锥形瓶溶液由蓝色变为无色,且半分钟不复原
④C(V2-4V1)/4V
⑤Fe(OH )3
本题解析:(1)根据图像可知,pH≤2.0时,CIO2—也能被I- 完全还原成Cl—,那么I-要被氧化为碘单质,溶液是酸性溶液,则可正确写出离子方程式即反应的离子方程式是ClO2-+4I-+4H+=Cl-+2H2O+2I2。
完全还原成Cl—,那么I-要被氧化为碘单质,溶液是酸性溶液,则可正确写出离子方程式即反应的离子方程式是ClO2-+4I-+4H+=Cl-+2H2O+2I2。
(2)根据曲线图示在pH≤2.0时, ClO2被I-还原只生成Cl-,pH≥7.0时,ClO2被I-还原只生成ClO2-;而用ClO2处理过的饮用水,其pH为5.5~6.5,所以其中既含有ClO2,又含有ClO2-,若将溶液的pH调节为7.0~8.0,则第一阶段滴定时只是ClO2被I-还原只生成ClO2-,溶液的ClO2-没有被I-还原,所以第二阶段滴定前应调节溶液的pH≤2.0,使ClO2-与I-反应,以测定样品水样中亚氯酸根离子的含量。
(3)由于碘遇淀粉显蓝色,所以终点时的现象判断依据为锥形瓶溶液由蓝色变为无色,且半分钟不复原。
(4)由2ClO2+2I-=2ClO2-+I2和Na2S2O3+I2=Na2S4O6+2NaI可知
2ClO2-?~? Na2S2O3
则n(ClO2-)? c×V1/1000 n(ClO2-)=2 c×V1/1000
由ClO2-+4H++4I-=Cl-+2I2+2H2O 和Na2S2O3+I2=Na2S4O6+2NaI可得
ClO2-~? 2 Na2S2O3
n(ClO2-)总 c×V2/1000
n(ClO2-)总=1/2 c×V2/1000
所以原水样中ClO2-浓度=[ 1/2 c×V2/1000-2 c×V1/1000]/V/1000
=c(V2-4V1)/4V
(5)根据反应4Fe2++ClO2-+2H2O 4Fe3++Cl-+4OH-,Fe3++ OH-
4Fe3++Cl-+4OH-,Fe3++ OH- Fe(OH)3可知,氧化产物为Fe(OH)3。
Fe(OH)3可知,氧化产物为Fe(OH)3。
点评:该题是高考中的常见图像,难度较大,学生不易得分。该题既有定性的分析,也有定量的计算,另外还要结合图表和图像,增加了试题的难度。该类试题要求学生必须认真、细致的审题,联系所学过的知识和技能,进行知识的类比、迁移、重组,全面细致的思考才能得出正确的结论。
本题难度:困难
2、填空题 由H2和Cl2组成的混合气体,经光照充分反应后,通入到100 mL 1 mol·L-1的NaOH溶液中,图A表示溶液中某种离子的物质的量随着通入气体体积的变化而变化的曲线,图B表示溶液中的导电性随着通入气体体积的变化而变化的曲线。

(1)图A表示溶液中_____________________________离子的变化曲线,说明曲线下降的原因:____________________________________________________________________________。
(2)对溶液进行导电性实验,当通入的混合气体体积大于V1时,引起溶液导电性明显增强的主要阳离子是___________。
(3)当n="0.02" mol时,光照前的混合气体中H2和Cl2的物质的量之比为___________。
参考答案:(1)ClO-?当通入的气体开始过量时,溶液呈酸性,发生反应:H++ClO- HClO,使n(ClO-)减少
HClO,使n(ClO-)减少
(2)H+? (3)3∶5
本题解析:混合气体中H2和Cl2的物质的量之比可以等于1∶1,或大于1∶1,或小于1∶1,只有当小于1∶1时,混合气体经光照充分反应后,通入到NaOH溶液中发生反应:HCl+NaOH====NaCl+H2O,Cl2+2NaOH====NaCl+NaClO+H2O,过量的HCl与NaClO反应生成HClO和NaCl,n(ClO-)才先增后减。但是,由于ClO-+H+ HClO,n(ClO-)不会减少到为0,n(ClO-)="0.02" mol,依据方程式:
HClO,n(ClO-)不会减少到为0,n(ClO-)="0.02" mol,依据方程式:
Cl2+2NaOH="===NaCl+NaClO" +H2O,
0.02 mol? 0.04 mol? 0.02 mol
NaOH mol+HCl====NaCl+H2O,
(0.1-0.04)? 0.06 mol
H2?+? Cl2?="===?" 2HCl,
0.03 mol? 0.03 mol? 0.06 mol,
因此光照前的混合气体中H2和Cl2的物质的量之比为0.03 mol∶(0.02 mol+0.03 mol)=3∶5。
本题难度:简单
3、选择题 有一混合溶液,其中只含有Fe2+、Cl-、Br-、I-(忽略水的电离),Cl-、Br-、I-的个数比为2:3:4,向该溶液中通入氯气使溶液中Cl-和Br-的个数比为3:1,则通入氯气的物质的量与溶液中剩余Fe2+的物质的量之比为( )
A.7:4
B.7:3
C.7:2
D.7:1
参考答案:由题意可设Cl-、Br-、I-的物质的量分别为2mol、3mol、4mol,
由电荷守恒可得:2n(Fe2+)=n(Cl-)+n(Br-)+n(I-)=2mol+3mol+4mol=9mol,n(Fe2+)=4.5mol,通入氯气后,要满足 n(Cl-):n(Br-)=3:1,
Cl-只要增加7mol就可以,即需通入氯气3.5mol.4mol I-先消耗2mol氯气,3mol Fe2+消耗1.5mol氯气,
剩余Fe2+1.5mol,则通入氯气与剩余Fe2+的物质的量之比为:3.5:1.5=7:3,
故选B.
本题解析:
本题难度:一般
4、选择题 漂粉精的有效成分是
[? ]
A.Ca(OH)2
B.Ca(ClO)2
C.CaCl2
D.CaCO3
参考答案:B
本题解析:
本题难度:简单
5、选择题 氯水在空气中长期放置,不考虑水蒸发的情况下,下列微粒的物质的量会增多的是( )
A.ClO-
B.HClO
C.水
D.Cl-
参考答案:A、氯水在空气中长期放置,次氯酸会分解,次氯酸根离子的量减少,故A错误;
B、氯水在空气中长期放置,次氯酸会分解,量减少了,故B错误;
C、不考虑水的蒸发,水的量几乎不变,故C错误;
D、氯水在空气中长期放置,次氯酸会分解,得到的是稀盐酸,次氯酸中的氯元素变为氯离子,所以氯离子的量增多了,故D正确.
故选D.
本题解析:
本题难度:简单