微信搜索关注"91考试网"公众号,领30元,获取公务员、事业编、教师等考试资料40G!
1、选择题 下列各组物质的晶体中,化学键类型相同、晶体类型也相同的是?
[? ]
A.SO2?和 SiO2
B.CO2?和H2O
C.NaCl和HCl
D.CCl4和KCl
参考答案:B
本题解析:
本题难度:简单
2、选择题 下列物质中,含有非极性共价键的化合物是:
A.Na2O2
B.NaCl
C.NaOH
D.Br2
参考答案:A
本题解析:A中的Na2O2,钠离子与过氧根之间是离子键,而过氧根离子内部两个氧原子间是非极性共价键.
B选项, NaCl中只有离子键.
C选项,NaOH中钠离子与氢氧根离子之间是离子键,而氢氧元素间是极性共价键.
D选项, Br2是同种元素构成的双原子单质分子,含非极性共价键.
本题难度:简单
3、选择题 下列对一些实验事实的理论解释正确的是? ( )。
选项
| 实验事实
| 理论解释
|
A
| 氮原子的第一电离能大于氧原子
| 氮原子2p能级半充满
|
B
| CO2为直线形分子
| CO2分子为非极性分子
|
C
| 金刚石的熔点低于石墨
| 石墨熔融时除了破坏共价键,还需破坏范德华力
|
D
| HF的沸点高于HCl
| H-F的键能大于H-Cl
参考答案:A
本题解析:CO2分子是非极性分子,B不正确;石墨中碳碳键的键长短,作用力强,所以石墨的熔点高于金刚石的,C不正确;D不正确,由于HF分子间存在氢键引起的,答案选A。
点评:在比较晶体额熔沸点时,首先分清楚晶体类型,然后在根据相应的要求逐一进行比较。
本题难度:一般
4、选择题 下列电子式或结构式错误的是
[? ]
A.OH-的电子式 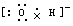
B.NH4Br的电子式 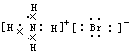
C.CCl4电子式 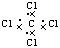
D.H2O的结构式 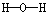
参考答案:C
本题解析:
本题难度:简单
5、选择题 A、B、C、D都是短周期元素,原子半径:D>C>A>B.已知A、B同周期,A、C同主族,C原子核内的质子数等于A、B原子核内的质子数之和,C原子最外层电子数是D原子最外层电子数的3倍.下列说法中正确的是( )
A.B、C、D三种元素组成的化合物的化学式为D2CB2
B.A、C两元素处在元素周期表中的第ⅥA族
C.B、C、D三种元素的简单离子的半径大小顺序为:C>D>B
D.B、D两元素可形成两种离子化合物,其阴、阳离子数之比均为1:2
参考答案:A、B、C、D都是短周期元素,根据原子半径D>C>A>B,且A、B同周期,A、C同主族,推知A、B、C、D在周期表中的大致相对位置为:
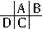
,C原子序数等于A原子序数+8,C原子核内的质子数等于A、B原子核内的质子数之和,故B原子序数为8,故B为氧元素.
C原子最外层电子数是D原子最外层电子数的3倍,若D的最外层电子数为1,则C为铝元素,A为硼元素,D为钠元素;若D的最外层电子数为2,则C为硫元素,A为氧元素,不合题意.
所以A为硼元素,B为氧元素,C为铝元素,D为钠元素.
A、B为氧元素,C为铝元素,D为钠元素,B、C、D三种元素组成的化合物的化学式为NaAlO2,故A错误;
B、A为硼元素,C为铝元素,最外层电子数都为3,两元素处在元素周期表中的第ⅢA族,故B错误;
C、B、C、D三种元素的简单离子分别为O2-、Al3+、Na+,三种离子核外电子排布相同,核电核数越大,离子半径越小,则有O2->Na+>Al3+,故C错误;
D、B为氧元素,D为钠元素,B、D两元素组成的离子化合物Na2O、Na2O2中阴、阳离子的个数比都为1:2,故D正确.
故选D.
本题解析:
本题难度:简单
|