微信搜索关注"91考试网"公众号,领30元,获取公务员、事业编、教师等考试资料40G!
1、选择题 配制一定物质的量浓度的NaOH溶液时,造成所配溶液浓度偏高的原因可能是( )
A.容量瓶中原来含有少量蒸馏水
B.烧杯中溶解NaOH后,未经冷却,立即转移至容量瓶并洗涤烧杯,定容
C.溶解NaOH的烧杯没有洗涤
D.向容量瓶中加水定容时眼睛一直仰视刻度线
参考答案:B
本题解析:
本题难度:一般
2、填空题 实验室用Na2SO4?10H2O配制500ml,0.100mol/L的Na2SO4溶液
(1)所需主要仪器为:药匙、托盘天平、烧杯、胶头滴管、______、______.
(2)本实验须称量硫酸钠晶体(Na2SO4?10H2O)为______g.
(3)用Na2SO4?10H2O配制标准溶液的正确顺序是______.
A.冷却?B.称量?C.洗涤?D.定容?E.溶解?F.摇匀?G.移液
(4)配制过程中出现以下情况,对所配溶液浓度有何影响(填“偏高”“偏低”“不变”)
①没有洗涤烧杯和玻璃棒.______.
②定容时俯视容量瓶的刻度线.______.
参考答案:(1)根据实验操作的步骤有计算、称量、溶解、冷却、移液、洗涤、定容、摇匀等操作,一般用托盘天平称量,用药匙取用药品,在烧杯中溶解,冷却后转移到500mL容量瓶中,并用玻璃棒引流,当加水至液面距离刻度线1~2cm时,改用胶头滴管滴加,所以需要的仪器为:托盘天平、药匙、烧杯、玻璃棒、500mL容量瓶、胶头滴管,
故答案为:500mL容量瓶、玻璃棒;
(2)Na2SO4的物质的量n=cV=0.1mol?L-1×0.5L=0.05mol,Na2SO4?10H2O的物质的量等于Na2SO4的物质的量,所以Na2SO4?10H2O的质量0.05mol×322g/mol=16.1g,故答案为:16.1;
(3)因实验操作的步骤有计算、称量、溶解、冷却、移液、洗涤、定容、摇匀等操作,故答案为:BEAGCDF;
(4)①因烧杯和玻璃棒上沾有溶质,没有洗涤烧杯和玻璃棒,溶质的质量偏少,溶液的浓度偏低,故答案为:偏低;
②定容时俯视容量瓶的刻度线,液面还没有达到刻度线,溶液的体积偏小,浓度偏大,故答案为:偏大.
本题解析:
本题难度:一般
3、填空题 实验室要配制100mL1.0mol?L-1的NaCl溶液,试回答下列各题:
(1)经计算,应该用托盘天平称取NaCl固体______g.
(2)若用NaCl固体配制溶液除需用烧杯、玻璃棒、药匙、托盘天平、洗瓶外还需要用到的玻璃仪器有______、______.
(3)容量瓶上除刻度线外还应标有______、______,使用容量瓶前第一步要______.
(4)下列四项错误操作会导致所得溶液浓度偏高的是______(填序号).
A.定容时仰视容量瓶刻度线?B.定容时俯视容量瓶刻度线
C.将溶解冷却后的溶液转入容量瓶中就直接进行定容操作
D.定容后,把容量瓶倒置摇匀后发现液面低于刻度线.
参考答案:(1)NaCl的物质的量n=cV=0.1L×1.0mol?L-1=0.1mol,NaCl的质量为0.1mol×58.5g/mol=5.85g,因天平的精确度为0.1g,所以托盘天平实际称取NaCl固体的质量为5.9g,故答案为:5.9;
(2)配制步骤有计算、称量、溶解、冷却、移液、洗涤、定容、摇匀等操作,一般用托盘天平称量,用药匙取用药品,在烧杯中溶解,冷却后转移到100mL容量瓶中,并用玻璃棒引流,当加水至液面距离刻度线1~2cm时,改用胶头滴管滴加,所以需要的仪器为:托盘天平、药匙、烧杯、玻璃棒、100mL容量瓶、胶头滴管,故答案为:100mL容量瓶、胶头滴管;
(3)因容量瓶上标有温度、容量、刻度线,容量瓶使用前必须检漏,故答案为:温度、容量、刻度线;检漏;
(4)A.定容时仰视容量瓶刻度线,溶液的液面超过刻度线,体积偏大,浓度偏小,故A错误;
B.定容时俯视容量瓶刻度线,溶液的液面低于刻度线,体积偏小,浓度偏大,故B正确;
C.将溶解冷却后的溶液转入容量瓶中就直接进行定容操作,因未洗涤,会使溶质的质量减少,浓度偏小,故C错误
D.定容后,把容量瓶倒置摇匀后发现液面低于刻度线,滞留在刻度线以上的液体过会儿下来,体积不变,浓度不变,故D错误;
故选:B.
本题解析:
本题难度:一般
4、简答题 化学是一门以实验为基础的学科,熟练使用中学化学实验中的常见仪器,熟悉常见实验用品是正确进行实验的基础.试回答以下问题:
实验室需要0.1mol?L-1?NaOH溶液450mL和0.5mol?L-1硫酸溶液500mL.根据这两种溶液的配制情况回答下列问题:
(1)如图所示的仪器中配制溶液肯定不需要的是______(填序号),配制上述溶液还需用到的玻璃仪器是______(填仪器名称).
(2)下列操作中,容量瓶所不具备的功能有______(填序号).
A.配制一定体积准确浓度的标准溶液
B.贮存溶液
C.测量容量瓶规格以下的任意体积的液体
D.准确稀释某一浓度的溶液
E.量取一定体积的液体
F.用来加热溶解固体溶质
(3)根据计算用托盘天平称取NaOH的质量为______g.在实验中其他操作均正确,若定容时仰视刻度线,则所得溶液浓度______0.1mol?L-1(填“大于”、“等于”或“小于”).
(4)根据计算得知,所需质量分数为98%、密度为1.84g/cm3的浓硫酸的体积为______mL(计算结果保留一位小数).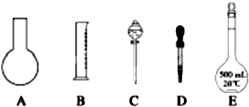
参考答案:(1)配制步骤有计算、称量、溶解、冷却、移液、洗涤、定容、摇匀等操作,一般用托盘天平称量,用药匙取用药品,在烧杯中溶解(可用量筒量取水),冷却后转移到100mL容量瓶中,并用玻璃棒引流,当加水至液面距离刻度线1~2cm时,改用胶头滴管滴加,所以需要的仪器为:托盘天平、药匙、烧杯、筒量、玻璃棒、容量瓶、胶头滴管,所以不需要的仪器是AC,还需要的仪器是烧杯和玻璃棒.
故答案为:AC;玻璃棒、烧杯;
(2)容量瓶不能用于贮存、加热溶液,溶解固体溶质等,只有1个刻度线不能测量容量瓶规格以下的任意体积的液体,故答案为:BCEF;
(3)m=nM=CVM=0.1mol/L×0.5L×40g/mol=2g,在容量瓶中定容时俯视容量瓶刻度线,导致溶液的体积偏小,所以配制溶液的浓度偏大,故答案为:2.0;大于;
(4)浓硫酸的物质的量浓度为:c=103ρwM=103×1.84×98%98mol/L=18.4mol/L;设需要浓硫酸的体积为V,0.5mol/L×0.5L=18.4mol/L×V,V=0.0136L=13.6mL,故答案为:13.6.
本题解析:
本题难度:一般
5、填空题 把18.0 mol·L-1的浓硫酸稀释成2.00 mol·L-1的稀硫酸100ml,实验操作如下,
1、将配好的稀硫酸倒入试剂瓶中,贴好标签;
2、盖好容量瓶塞,反复颠倒摇匀;
3、用量筒量取___________ml的18.0mol·L-1的浓硫酸;
4、将___________沿烧杯内壁慢慢注入盛有少量___________的烧杯中;
5、用少量蒸馏水洗涤烧杯2~3次,并将洗涤液也全部转移到容量瓶中;
6、将已冷却至室温的硫酸溶液沿玻璃棒注入___________;
7、改用胶头滴管逐滴加蒸馏水,至____________________________;
8、继续向容量瓶中加蒸馏水,直到液面接近刻度线1~2cm处;
(1)将上述步骤按正确的顺序排列_____________________
(2)填写上述步骤中的有关空格。
参考答案:(1)3、4、6、5、7、8、2、1
(2)11.1;浓硫酸;蒸馏水;100mL容量瓶;凹液面与刻度线相切
本题解析:
本题难度:一般