微信搜索关注"91考试网"公众号,领30元,获取公务员、事业编、教师等考试资料40G!
1、选择题 在无色透明的酸性溶液中,能较大量共存的离子组是(?)
A.MnO4-、K+、SO42-、Na+
B.Na+、SiO32-、K+、NO3-
C.NH4+、NO3-、Al3+、Cl-
D.K+、SO42-、HCO3-、Na+
参考答案:C
本题解析:A. MnO4-是紫色的,在无色溶液中不能存在,错误;B. 在酸性溶液在SiO32-会形成硅酸沉淀,不能大量存在,错误;C. NH4+、NO3-、Al3+、Cl-在无色透明的酸性溶液中不会发生任何反应,可以大量共存,正确;D. 在酸性溶液中HCO3-会发生离子反应产生CO2气体不能大量共存,错误。
本题难度:一般
2、推断题 某混合物的水溶液中,可能含有以下离子中的若干种:K+、Mg2+、Fe3+、Al3+、Cl-、CO32-和SO42-。现每次取100.00mL进行实验:
①第一份加入AgNO3溶液有沉淀产生;
②第二份加入足量BaCl2溶液后得干燥沉淀6.27g,沉淀经足量盐酸洗涤,干燥后剩余2.33g。
请回答:
(1)c(CO32-)=______________。
(2)用离子方程式表示该溶液呈碱性的原因:____________________________________。
(3)K+是否存在?_____,(填“是”或“否”)若存在,浓度范围是______________________ (若不存在,则不必回答第(2)问)。
(4)根据以上实验,不能判断哪种离子是否存在?若存在,这种离子如何进行检验?
____________________________________________________________________。
参考答案:(1) 0.2mol·L-1(2分)
(2)CO32-+H2O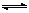 HCO3-+OH-(2分)
HCO3-+OH-(2分)
(3)是(2分) c(K+)≥0.6mol·L-1(2分)
(4)Cl-;取原溶液少许,加入足量Ba(NO3)2溶液后过滤,向滤液中加入AgNO3溶液,若有沉淀产生,则原溶液中有Cl-,反之无Cl-(3分)
本题解析:第一份加入AgNO3溶液有沉淀产生,则沉淀有可能是硫酸银(微溶)、碳酸银(不溶)或氯化银(不溶);第二份得沉淀后加盐酸,沉淀变少,说明2.33g是硫酸钡,6.27-2.33=3.94g是碳酸钡,所以碳酸钡为3.94g÷188g/mol=0.02nol,则c(CO32-)=0.2mol·L-1。(3)因为溶液存在CO32-和SO42-,所以一定不存在Mg2+、Fe3+、Al3+,则一定K+;硫酸钡为0.01mol,碳酸钡为0.02nol,则负电荷最少为0.06mol,故K+的浓度最少为0.6mol·L-1。(4)硫酸银(微溶)、碳酸银(不溶),所以不能判断第一份的沉淀是否有氯化银,故无法判断是否有Cl-。
点评:离子共存问题是历年高考的重点,考生在备考中要注意积累常见的化学反应,并注意题文中隐藏的条件。
本题难度:一般
3、填空题 现有CO32-、K+、SO42-、Cl-、Al3+、Fe3+、HCO3-、Ba2+八种离子,试按要求填空:
(1)只能与H+大量共存,不能与OH-大量共存的有______________________。
(2)只能与OH-大量共存,不能与H+大量共存的有______________________。
(3)既能与H+大量共存,又能与OH-大量共存的有_______________________。
(4)既不能与H+大量共存,又不能与OH-大量共存的有____________________。
参考答案:(1)Al3+、Fe3+?(2)CO32-(3)K+、SO42-、Cl-、Ba2+?(4)HCO3-
本题解析:(1)Al3+、Fe3+只能与H+大量共存,不能与OH-大量共存。
(2)CO32-只能与OH-大量共存,不能与H+大量共存。
(3)既能与H+大量共存,又能与OH-大量共存的有K+、SO42-、Cl-、Ba2+。
(4)既不能与H+大量共存,又不能与OH-大量共存的有HCO3-。
点评:该题是高考中的常见题型和考点,属于基础性试题的考查。试题基础性强,侧重对学生基础知识的巩固和训练,旨在考查学生灵活运用基础知识解决实际问题的能力,有利于培养学生的逻辑推理能力和发散思维能力。该题的关键是记住常见与氢离子和OH-反应的离子,然后结合题意灵活运用即可。
本题难度:一般
4、计算题
(1)a值可否等于3(填“可”或“否”)_______,其理由是__________________。
(2)a值可否等于5(填“可”或“否”)_______,其理由是__________________。
(3)a的取值范围是_____________。
参考答案:(1) 否?若a=3,则由a=0.5b推知b=6,这与pH=6的溶液是强碱溶液相矛盾.
(2) 否?若a=5,则ca(H+)=10-5 mol·L-1
再由a=0.5b推知b=10,则cb(H+)=10-10 mol·L-1,cb(OH-)=10-4 mol·L-1
由于酸碱相混恰好中和,所以
Va·ca(H+)=Vb·cb(OH-)
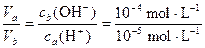 =10>1
=10>1
这与题意Va<Vb不符。
(3)  。
。
本题解析:(1)若a=3,则由a=0.5b推知b=6,这与pH=6的溶液是强碱溶液相矛盾,故答案为:否。
(2)若a=5,则ca(H+)=10-5 mol·L-1
再由a=0.5b推知b=10,则cb(H+)=10-10 mol·L-1,cb(OH-)=10-4 mol·L-1
由于酸碱相混恰好中和,所以
Va·ca(H+)=Vb·cb(OH-)
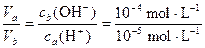 =10>1
=10>1
这与题意Va<Vb不符,故答案仍为:否。
(3)由题意知,Va·ca(H+)=Vb·cb(OH-),则
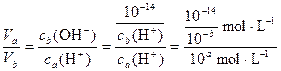 =10a+b-14
=10a+b-14
因为Va<Vb即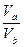 <1,则
<1,则
10a+b-14<1=100?a+b-14<0
将a=0.5b代入得:a<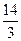
又因为pH=b=2a>7(碱性溶液)
所以,a>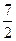 ;
;
总之, 。
。
本题难度:一般
5、选择题 下列各组离子在碱性条件下可以大量共存,而在强酸性条件下能发生氧化还原反应的是
[? ]
A.Cu2+、Fe2+、NO3-、Cl-
B.K+、Mg2+、HCO3-、SO42-
C.Na+、K+、S2-、SO42-
D.Ba2+、Na+、I-、Cl-
参考答案:C
本题解析:
本题难度:一般