|
高中化学知识点总结《影响化学反应速率的因素》考点巩固(2017年最新版)(二)
2017-07-27 08:22:33
来源:91考试网
作者:www.91exam.org 【 大 中 小】
|
微信搜索关注"91考试网"公众号,领30元,获取公务员、事业编、教师等考试资料40G!
1、选择题 0.100 mL 6 mol·L-1 H2SO4跟过量锌粉反应,在一定温度下,为了减缓反应速率,但又不影响生成氢气的总量,可向反应物中加入适量下列物质中的:①硫酸钠固体 ②水 ③硫酸钾溶液 ④硝酸钾溶液 ⑤醋酸钠固体 ⑥硫酸铜固体
A.②③⑤
B.①④⑤
C.②③⑥
D.③④⑥
|
参考答案:A
本题解析:
试题分析:因为锌粉过量,故产生氢气的总量,取决于氢离子的物质的量的多少,反应速率取决于氢离子浓度的大小。①加入硫酸钠固体,与硫酸不反应,体积不发生变化,故无影响;②加水,氢离子浓度减小,反应速率减慢,②正确;加入硫酸钾溶液,相当与加水稀释,氢离子浓度减小,速率减小,氢离子的总物质的量不变,故③正确;加入硝酸钾,在硫酸中相当于构成了硝酸的溶液,硝酸具有较强的氧化想,不再产生氢气,④错误;加入醋酸钠,醋酸根离子与氢离子结合生成醋酸溶液,醋酸是弱电解质,故氢离子浓度降低,反应速率减慢,但氢离子总物质的量不发生变化,故产生氢气的总量不变,⑤正确;加入硫酸铜固体,锌置换成硫酸铜中的铜,构成铜锌原电池,加快反应速率,⑥错误,故答案选A.
考点:影响化学反应速率的因素
本题难度:一般
2、简答题 某学生为了探究锌与盐酸反应过程中速率变化.在100mL稀盐酸中加入足量的锌粉,标准状况下测得数据累计值如下:
| 时间(min) | 1 | 2 | 3 | 4 | 5
氢气体积(mL)
50
120
232
290
310
|
(1)在0~1、1~2、2~3、3~4、4~5min时间段中,反应速率最大的时间段是______,原因为______;反应速率最小的时间段是______,原因为______.
(2)在2~3min时间段内,用盐酸的浓度变化表示的反应速率为______.
(3)为了减缓反应速率但不减少产生氢气的量,在盐酸中分别加入等体积的下列溶液:A.蒸馏水?B.Na2SO4溶液?C.NaNO3溶液?D.CuSO4溶液?E.Na2CO3溶液,你认为可行的是______.
参考答案:(1)在0~1、1~2、2~3、3~4、4~5min时间段中,产生气体的体积分别为50mL、70mL、112mL、68mL、20mL,由此可知反应速率最大的时间段为2~3?min,因反应为放热反应,温度升高,反应速率增大,反应速率最小的时间段是4~5min时间段,此时温度虽然较高,但H+浓度小,
故答案为:2~3?min;因该反应是放热反应,此时温度高;4~5?min;因为此时H+浓度小;
(2)在2~3min时间段内,n(H2)=0.112L22.4L/mol=0.005mol,根据2HCl~H2,计算消耗盐酸的物质的量为0.01mol,
则υ(HCl)=0.01mol0.1L1min=0.1?mol/(L?min),
故答案为:υ(HCl)=0.1?mol/(L?min);
(3)A.加入蒸馏水,H+浓度减小,反应速率减小且不减少产生氢气的量,故A正确;?
B.加入Na2SO4溶液,H+浓度减小,反应速率减小且不减少产生氢气的量,故B正确;?
C.加入NaNO3溶液,生成NO气体,影响生成氢气的量,故C错误;?
D.加入CuSO4溶液,Zn置换出Cu反应速度增大,但影响生成氢气的量,故D错误;
?E.加入Na2CO3溶液,消耗H+,H+浓度减小,影响生成氢气的量,故E错误.
故答案为:A、B.
本题解析:
本题难度:一般
3、选择题 下图表示反应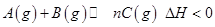 ,在不同条件下反应混合物中C的百分含量反应过程所需时间的关系曲线。下列有关叙述正确的是 ,在不同条件下反应混合物中C的百分含量反应过程所需时间的关系曲线。下列有关叙述正确的是
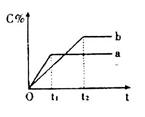
A.反应由逆反应开始
B.a表示有催化剂,b表示无催化剂
C.若n=2,其它条件相同,a比b的压强大
D.若其它条件相同,a比b的温度高
参考答案:D
本题解析:A、从图来看,C的含量从无到有,说明反应由正反应开始,错误;B、ab曲线说明化学平衡移动了,而使用催化剂只能改变反应速率,不能使平衡移动,错误;C、若n=2反应前后气体体积不变,改变压强只改变反应速率,错误;D、该反应正反应放热,升温使化学平衡左移,C的含量减少,a比b的温度高,正确。
本题难度:一般
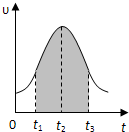
4、简答题 I.实验测得0.01mol/L的KMnO4的硫酸溶液和0.1mol/L的H2C2O4溶液等体积混合后,反应速率υ[mol/(L?s)]与反应时间t(s)的关系如图所示.回答如下问题:
(1)该反应的化学方程式:______
(2)0→t2时间段内反应速率增大的原因是:______,
(3)t2→t时间段内反应速率减小的原因是:______,
(4)图中阴影部分“面积”表示t1→t3时间里______.
A.Mn2+物质的量浓度的增大?B.Mn2+物质的量的增加
C.SO42-物质的量浓度?D.MnO4-物质的量浓度的减小
Ⅱ.为比较Fe3+和Cu2+对H2O2分解的催化效果,某化学研究小组的同学分别设计了如图甲、乙所示的实验.请回答相关问题:

?
(1)定性分析:如图甲可观察______,定性比较得出结论.有同学提出将FeCl3改为Fe2(SO4)3更为合理,其理由是______.
(2)定量分析:如图乙所示,实验时均以生成40mL气体为准,其他可能影响实验的因素均已忽略.图中仪器A的名称为______,实验中需要测量的数据是______
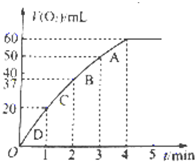
(3)加入0.01mol?MnO2粉末于60mL?H2O2溶液中,在标准状况下放出气体体积和时间的关系如图所示.设放出气体的总体积为V?mL.
①放出 mL气体时所需时间为______min.
②该H2O2溶液的浓度为______
③A、B、C、D各点反应速率快慢的顺序为______>______>______>______.
参考答案:I(1)该反应的反应物是KMnO4和 H2C2O4,高锰酸钾是强氧化剂,能把草酸氧化成二氧化碳,反应方程式为2KMnO4+5H2C2O4+3H2SO4=K2SO4+2MnSO4+10CO2↑+8H2O,
故答案为:2KMnO4+5H2C2O4+3H2SO4=K2SO4+2MnSO4+10CO2↑+8H2O;
(2)该反应是放热反应,温度越高,反应速率越快,所以温度是改变反应速率的主要原因,故答案为:反应放热,温度升高,反应速率加快;
(3)随着反应的进行,反应物的浓度降低,浓度越低,反应速率越小,所以浓度的改变是反应速率变化的主要原因,故答案为:反应物浓度降低,导致反应速率降低;
(4)根据v=△C△t,推倒得v×△t=△C,所以阴影面积表示反应物浓度的减少或生成物浓度的增加,故选AD;
Ⅱ(1)观察到的现象是:气泡生成的快慢;将FeCl3改为Fe2(SO4)3,两种物质的阴离子相同,只有阳离子相同,判断影响因素更有针对性,故答案为:产生气泡的快慢;消除阴离子不同对实验的干扰;
(2)根据v=△C△t,知需要测量的是气体的体积和时间,故答案为:分液漏斗;产生40mL气体所需的时间;
(3)①分析图象知,为1min;故答案为:1min;
②设H2O2溶液的浓度为x mol/L
? 2H2O2?MnO2?.?? 2 H2O+O2
? 2? 22.4L
? xmol/L×0.06L? 0.06L
x=0.09
?故答案为:0.09mol/L
③图象斜率的大小反映反应速率快慢,斜率越大,反应速率越快,故答案为:D>C>B>A.
本题解析:
本题难度:一般
5、实验题 (9分)某同学对第四周期过渡元素产生浓厚的兴趣。想探究是否只有MnO2能催化KClO3受热分解?CuO、Fe2O3、Cr2O3等对氯酸钾的受热分解有没有催化作用?若有催化作用,效率怎样?请你与他一起进行实验探究:
I.课题名称:_________________________。
Ⅱ.实验仪器:略
实验试剂:二氧化锰、氧化铁、氧化铜、氧化铬和氯酸钾
Ⅲ.实验步骤:略
Ⅳ.实验数据:
实验
编号
| KClO3
(g)
| 氧化物
| 产生气体(mL)
(已折算为标况)
| 耗时(s)
| 化学式
| 质量(g)
| 回收
| 1
| 0.6
| —
| —
| —
| 10
| 480
| 2
| 0.6
| MnO2
| 0.20
| 90%
| 67.2
| 36.5
| 3
| 0.6
| CuO
| 0.20
| 90%
| 67.2
| 79.5
| 4
| 0.6
| Fe2 O3 O3
| 0.20
| 90%
| 67.2
| 34.7
| 5
| 0.6
| Cr2O3
| 0.20
| 异常
| 67.2
| 188.3
|
V.实验讨论:
⑴请用编号3的实验数据求得KClO3的分解率:为______%(保留一位小数)。
⑵在用Cr2O3做实验时,有刺激性气味的气体产生,同时绿色的混合物变成橘黄色(K2Cr2O7)。该刺激性气体可能是______(填化学式),用?检验。(填序号)
A、湿润的蓝色石蕊试纸? B、湿润的碘化钾淀粉试纸
C、湿润的PH试纸? D、湿润的红色石蕊试纸
Ⅵ.实验结论:________________________________________________________。
参考答案:

本题解析:略
本题难度:一般
| 
