微信搜索关注"91考试网"公众号,领30元,获取公务员、事业编、教师等考试资料40G!
1、选择题 NO和CO都是汽车尾气中的物质,它们能很缓慢地反应生成N2和CO2,对此反应有关的叙述中不正确的是( )
A.增大压强能加快化学反应速率
B.使用适当催化剂可以加快化学反应速率
C.升高温度能加快化学反应速率
D.改变压强对化学反应速率没有影响
参考答案:A、对于有气体参加的化学反应,增大压强,化学反应速率加快,故A正确;
B、催化剂能改变反应的活化能,加入催化剂能改变反应速率,故B正确;
C、温度对任何化学反应的速率都会造成影响,升高温度,反应速率变大,故C正确;
D、对于有气体参加的化学反应,压强会对反应速率造成影响,故D错误;
故选:D.
本题解析:
本题难度:一般
2、选择题 在一密闭容器中有如下反应:aX(g)+bY(s)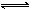 nW(g);ΔH=Q。某化学兴趣小组的同学根据此反应在不同条件下的实验数据,作出了如下曲线图:(?)
nW(g);ΔH=Q。某化学兴趣小组的同学根据此反应在不同条件下的实验数据,作出了如下曲线图:(?)
其中,ω(W)表示W在反应混合物中的百分含量,t表示反应时间。其它条件不变时,下列分析正确的是(?)
A.图Ⅰ可能是不同压强对反应的影响,且P2>P1,a<n
B.图Ⅱ可能是在同温同压下催化剂对反应的影响,且2使用的催化剂效果好
C.图Ⅱ可能是不同压强对反应的影响,且P1>P2,n=a+b
D.图Ⅲ可能是不同温度对反应的影响,且T1>T2,Q<0
参考答案:A
本题解析: A、方程中Y是固体,如果图Ⅰ表示压强的影响,2线用的时间短,说明速率快,压强大,P2>P1,增大压强,ω(W)减少,说明平衡向逆反应方向移动,想气体分子数减少的方向进行,a<n,正确;B、图Ⅱ可能是在同温同压下催化剂对反应的影响,1的时间短, 1使用的催化剂,效果好,错误;C、图Ⅱ可能是不同压强对反应的影响,且P1>P2,n=a,错误;D、图Ⅲ可能是不同温度对反应的影响,1用的时间短,速率快,温度高,T1>T2,升高温度,ω(W)增加,平衡向正反应方向移动,也就是向吸热反应方向移动,Q>0,错误。
本题难度:一般
3、填空题 (14分)碘在科研与生活中有重要应用,某兴趣小组用0.50 mol·L-1 KI、0.2%淀粉溶液、0.20 mol·L-1 K2S2O8、0.10 mol·L-1 Na2S2O3等试剂,探究反应条件对化学反应速率的影响。
已知:S2O82-+2I- 2SO42-+I2(慢) I2+2S2O32-
2SO42-+I2(慢) I2+2S2O32-  2I-+ S4O62-(快)
2I-+ S4O62-(快)
(1)向KI、Na2S2O3与淀粉的混合溶液中加入一定量的K2S2O8溶液,当溶液中的 耗尽后,溶液颜色将由无色变为蓝色,为确保能观察到蓝色,S2O32-与S2O82-初始的物质的量需满足的关系为:n(S2O32-)∶n(S2O82-) 。
(2)为探究反应物浓度对化学反应速率的影响,设计的实验方案如下表:
实验序号
| 体积V/mL
|
K2S2O8溶液
| 水
| KI溶液
| Na2S2O3溶液
| 淀粉溶液
|
①
| 10.0
| 0.0
| 4.0
| 4.0
| 2.0
|
②
| 9.0
| 1.0
| 4.0
| 4.0
| 2.0
|
③
| 8.0
| Vx
| 4.0
| 4.0
| 2.0
|
表中Vx mL,理由是 。
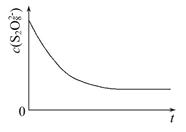
(3)已知某条件下,浓度c(S2O82-)反应时间t的变化曲线如图所示,若保持其他条件不变,请在答题卡坐标图中,分别画出降低反应温度和加入催化剂时c(S2O82-)-t的变化曲线示意图(进行相应的标注)
(4)碘也可用作心脏起搏器电源-锂碘电池的材料,该电池反应为:
2Li(s)+I2(s) 2LiI(s)ΔH
2LiI(s)ΔH
已知:①4Li(s)+O2(g) 2Li2O(s) ΔH1
2Li2O(s) ΔH1
②4LiI(s)+O2(g) 2I2(s)+2Li2O(s)ΔH2
2I2(s)+2Li2O(s)ΔH2
则电池反应的ΔH= ;碘电极作为该电池的 极。
参考答案:(1) Na2S2O3 <2
(2)2.0 保证反应物K2S2O8浓度改变,而其他的条件不变,才能达到实验目的;
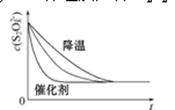
(3)
(4)(△H1-△H2)/2 正
本题解析:(1)根据题目所给信息可知,若溶液中仍存在Na2S2O3,则碘单质将不会存在,溶液不会变蓝色,所以只有将Na2S2O3消耗完时,溶液才会由无色变为蓝色;根据化学方程式,Na2S2O3与K2S2O8完全反应,溶液中不存在碘单质时,Na2S2O3与K2S2O8的物质的量之比为2:1,所以为确保能观察到蓝色,则Na2S2O3的量少些,则n(S2O32-)∶n(S2O82-)<2;
(2)实验①、②中KI溶液、Na2S2O3溶液、淀粉溶液的体积不变,且K2S2O8溶液与水的总体积是10.0mL,该实验的目的是探究反应物浓度对化学反应速率的影响,为保证反应物K2S2O8浓度改变,而其他的条件不变,才能达到实验目的,所以在实验③中K2S2O8溶液与水的总体积必须也是10.0mL,则Vx=2.0mL;
(3)降低温度,该反应的反应速率减慢,而使用催化剂则会加快反应速率,反应完全时溶液中c(S2O82-)不变,所以对应的图像为 ;
;
(4)在2Li(s)+I2(s) 2LiI(s)中I元素的化合价降低,发生还原反应,所以碘作电池的正极,根据盖斯定律可知,ΔH=(①-②)/2=(△H1-△H2)/2.
2LiI(s)中I元素的化合价降低,发生还原反应,所以碘作电池的正极,根据盖斯定律可知,ΔH=(①-②)/2=(△H1-△H2)/2.
考点:考查对实验现象的分析,化学反应速率与图像的关系,盖斯定律的应用
本题难度:困难
4、填空题 铁和铝是两种重要的金属,它们的单质及化合物有着各自的性质。
(1)在一定温度下,氧化亚铁可以与一氧化碳发生下列反应:
Fe2O3(s)+3CO(g) 2Fe(s)+3CO2(g)ΔH>0
2Fe(s)+3CO2(g)ΔH>0
①该反应的平衡常数表达式为:K=____________
②该温度下,在2L盛有粉末的密闭容器中通入CO气体,10min后,生成了单质铁11.2g。则10min内CO的平均反应速率为___________
(2)某些金属氧化物粉末和Al粉在镁条的引燃下可以发生铝热反应。下列反应速率(v) 和温度(T)的关系示意图中与铝热反应最接近的是_________
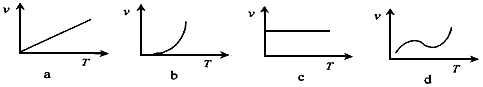
(3)Fe3+盐和Al3+盐在性质上有很多相似的地方,如遇碱都生成难溶的胶状沉淀,可用于净水;也有不同之处,如Fe3+既有氧化性又有还原性,Al3+只有氧化性。但Fe3+只有在碱性介质中才能被氧化为FeO42-,请完成下列方程式:?

(4)若将ag Fe和Al的混合物溶于2mol/L的足量的硫酸中,再往溶液中加入足量的6mol/L的NaOH溶液,充分反应,过滤,洗涤,干燥灼烧,称量所得固体的质量仍为ag,则原混合物中Al的质量分数为_________
参考答案:(1)①c3(CO2)/c3(CO);②0.015mol·L-1·min-1
(2)b (3)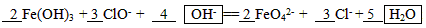 (4)30%
(4)30%
本题解析:
本题难度:一般
5、选择题 下列不同条件下的化学反应A+B=C+D,反应速率按由大到小的顺序排列,正确的一组是
[? ]
①常温下20 mL含A和B各0.001 mol
②常温下100 mL含A和B各0.01 mol
③常温下0.05 mol/L的A,B溶液各10 mL,再加入蒸馏水20 mL
④常温下100 mL含A 0.01 mol和20 mL 含B 0.001 mol
A.①②③④
B.④③②①
C.②④①③
D.②①④③
参考答案:C
本题解析:
本题难度:一般