| 高考省级导航 | |
|
|
| 高考省级导航 | |
|
|
|
高中化学知识点归纳《物质的量》考点巩固(2017年最新版)(六)
参考答案:C 本题解析:根据溶液中的电荷守恒有:c(Na+) +3 c(Fe3+)="2" c(SO42-) ,有c(Na+) +3×0.4 mol/L="0.7" mol/L×2 本题难度:一般 3、选择题 用NaOH固体,配制240mL 0.5mol/LNaOH溶液,在下列仪器中正确的是( ) 参考答案:配制240mL溶液,实验室没有240mL的容量瓶,需要选用250mL的容量瓶; 本题解析: 本题难度:简单 4、选择题 用NA表示阿伏加德罗常数的值。下列说法正确的是 |
参考答案:
本题解析:
本题难度:一般
5、计算题 (8分)臭氧(O3)能与KI溶液反应,生成O2等。在反应后的溶液中滴入酚酞变为红色,若滴入淀粉则变为蓝色。为测定某环境空气中的臭氧含量,将0℃、1.01×105Pa的空气33.6m3通过KI溶液,使之完全反应,所得溶液用0.0100mol·L-1的Na2S2O3溶液60.0mL恰好滴定达终点。反应方程式为:2Na2S2O3+I2=Na2S4O6+2NaI。
(1)臭氧通入KI溶液中的化学方程式:
(2)滴定过程中选择的指示剂是 ,达到滴定终点时的现象为 ;
(3)计算该空气中臭氧的体积分数。
参考答案:(8分)
(1) ===
===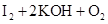 (2分)
(2分)
(2)淀粉 (1分) 溶液由蓝色变为无色(1分)
(3)由化学方程式得:
O3————————————I2————————————2Na2S2O3
1mol 2mol
n(O3) 0.0100mol/L×0.0600L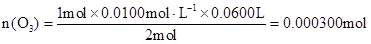 ………………(2分)
………………(2分)
则大气中臭氧的体积分数为: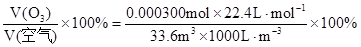
 ……………………………………(2分)
……………………………………(2分)
本题解析:
(1)臭氧通入KI溶液中,臭氧作为氧化剂,碘化钾被氧化生成碘单质,方程式为 ===
===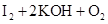 ;
;
(2)Na2S2O3溶液滴定到终点时,碘单质恰好反应完全,此时若加入淀粉作为指示剂,溶液颜色则有蓝色变为无色。
(3)根据这两个方程式: ===
===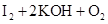 ;
; ,找出O3与Na2S2O3关系如下:
,找出O3与Na2S2O3关系如下:
O3————————————I2————————————2Na2S2O3
1mol 2mol
n(O3) 0.0100mol/L×0.0600L
计算臭氧的体积分数是: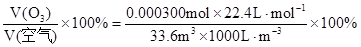 =
=
考点:考查酸碱中和滴定知识、氧化还原反应方程式的书写及化学计算。
点评:氧化还原反应方程式的书写及中和滴定数据的处理是高中学生学习的一个难点,容易失分,本题属于中等题。
本题难度:困难
| 【大 中 小】【打印】 【繁体】 【关闭】 【返回顶部】 | |
| 下一篇:高考化学知识点归纳《物质的量》.. | |