|
|
|
高中化学知识点大全《盐类水解的原理》考点预测(2017年强化版)(六)
2017-07-27 08:32:02
来源:91考试网
作者:www.91exam.org 【 大 中 小】
|
微信搜索关注"91考试网"公众号,领30元,获取公务员、事业编、教师等考试资料40G!
1、选择题 要除去MgCl2酸性溶液中少量的FeCl3,不宜选用的试剂是
A.MgO
B.MgCO3
C.NaOH
D.Mg(OH)2
|
参考答案:C
本题解析:将pH调节到3左右。如使用NaOH,pH过高导致镁离子沉淀。
本题难度:简单
2、填空题 (10分)物质在水中可能存在电离平衡、盐的水解平衡和沉淀的溶解平衡,它们都可看作化学平衡。请根据所学知识回答:
(1)A为0.1 mol·L-1的(NH4)2SO4溶液,在该溶液中各种离子的浓度由大到小顺序为________。
(2)B为0.1 mol·L-1NaHCO3溶液,实验测得NaHCO3溶液的pH>7,请分析NaHCO3溶液显碱性的原因:________________________________________。
(3)C为FeCl3溶液,实验室中配制FeCl3溶液时通常需要向其中加入________,目的是_______________;
若把B和C溶液混合,将产生红褐色沉淀和无色气体,该反应的离子方程式为__________________。
参考答案:(每空2分,共10分)
(1)c(NH4+)>c(SO42-)>c(H+)>c(OH-)
(2)HCO3-水解程度大于电离程度
(3)盐酸 抑制Fe3+水解 Fe3++3HCO3-===Fe(OH)3↓+3CO2↑
本题解析:(1)硫酸铵完全电离出2个铵根离子和1个硫酸根离子,因为铵根离子水解,溶液显酸性,所以离子浓度关系为:c(NH4+)>c(SO42-)>c(H+)>c(OH-)。(2)碳酸氢钠溶液显碱性,说明HCO3-水解程度大于电离程度。(3)氯化铁溶液中铁离子水解显酸性,所以加入盐酸抑制水解。将氯化铁和碳酸氢钠混合,铁离子和碳酸氢根离子双水解生成氢氧化铁沉淀和二氧化碳,方程式为:Fe3++3HCO3-===Fe(OH)3↓+3CO2↑
考点:盐类的水解和应用
本题难度:一般
3、填空题 雾霾含有大量的污染物SO2、NO。工业上变“废”为宝,吸收工业尾气SO2和NO,可获得Na2S2O4和NH4NO3产品的流程图如下(Ce为铈元素):

(1)装置Ⅰ中的主要离子方程式为 。
(2)含硫各微粒(H2SO3、HSO3-和SO32-)存在于SO2与NaOH溶液反应后的溶液中,它们的物质的量分数X(i)与溶液pH 的关系如图所示。
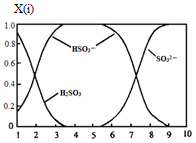
①若是0.1molNaOH反应后的溶液,测得溶液的pH=8时,溶液中个离子由大到小的顺序是 。
②向pH=5的NaHSO3溶液中滴加一定浓度的CaCl2溶液,溶液中出现浑浊,pH降为2,用化学平衡移动原理解释溶液pH降低的原因: 。
(3)写出装置Ⅱ中,酸性条件下的离子方程式 。
(4)装置Ⅲ还可以使Ce4+再生,其原理如下图所示。
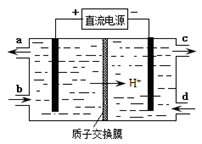
①生成Ce4+从电解槽的 (填字母序号)口流出。
②写出与阴极的反应式 。
(5)已知进入装置Ⅳ的溶液中,NO2-的浓度为a g·L-1,要使1 m3该溶液中的NO2-完全转化为NH4NO3,需至少向装置Ⅳ中通入标准状况下的O2 L。(用含a代数式表示,计算结果保留整数)
参考答案:(每空2分)
(1)SO2 + OH-="==" HSO3-
(2)①c(Na+>c(SO32-)>c(HSO3-)>c(OH-)>c(H+)
②HSO3- 在溶液中存在电离平衡:HSO3- SO32-+H+,加入CaCl2溶液后,Ca2++SO32-="==" CaSO3↓使电离平衡右移,c(H+)增大。 SO32-+H+,加入CaCl2溶液后,Ca2++SO32-="==" CaSO3↓使电离平衡右移,c(H+)增大。
(3)NO+2H2O+3Ce4+===3Ce3++NO3-+4H+、NO+H2O+Ce4+===Ce3++NO2-+2H+
(4)①a ②2HSO3-+4H++ 4e-="==" S2O32-+3H2O
(5)243a(242a、244a、5600a /23都给分)
本题解析:(1)装置Ⅰ中的将SO2变成了HSO3-,离子方程式是SO2 + OH-="==" HSO3-。
(2)①若是0.1molNaOH反应后的溶液,测得溶液的pH=8时,图像中的c(SO32-)>c(HSO3-),而c(OH-)=10-6mol/L,远小于c(OH-),故溶液中离子浓度为:c(Na+>c(SO32-)>c(HSO3-)>c(OH-)>c(H+)。②HSO3- 在溶液中存在电离平衡:HSO3- SO32-+H+,加入CaCl2溶液后,Ca2++SO32-="==" CaSO3↓使电离平衡右移,c(H+)增大。 SO32-+H+,加入CaCl2溶液后,Ca2++SO32-="==" CaSO3↓使电离平衡右移,c(H+)增大。
(3)在酸性条件下装置Ⅱ中,Ce4+将NO氧化为NO3-或NO2-,本身还原为Ce3+,有两个反应,即NO+2H2O+3Ce4+===3Ce3++NO3-+4H+、NO+H2O+Ce4+===Ce3++NO2-+2H+。
(4)装置Ⅲ使Ce3+→Ce4+,反应过程失去电子,在阳极发生,接电源正极,故生成Ce4+从电解槽的a口出来;阴极HSO3-得到电子生成S2O32,即2HSO3-+4H++ 4e-="==" S2O32-+3H2O。
(5)装置Ⅳ中的与O2和NO2-参加的反应:2NH3+2H++O2+2NO2-===2NH4NO3,n(O2)=n(NO2-)= ×1000L×a g·L-1/46g·mol-1,V(O2)=22.4L·mol-1 n(O2)= 243a。
考点:离子方程、电极反应式的书写及简单化学计算。
本题难度:困难
4、选择题 下列溶液中各微粒的浓度关系不正确的是
A.0.1mol·L-1 HCOOH溶液中:c(HCOO-)+c(OH-)=c(H+)
B.0.1mol·L-1 NH4Cl溶液中:c(NH4+)+c(NH3?H2O)=c(Cl-)
C.0.1mol·L-1NaHCO3溶液中:c(Na+)+c(H+)+c(H2CO3)=c(HCO3-)+c(CO32-)+c(OH-)
D.等体积、等物质的量浓度的CH3COONa和弱酸CH3COOH混合后的溶液中:c(CH3COO-)
|
参考答案:
本题解析:
本题难度:一般
5、简答题 (12分)研究表面,可用NaBH4与水反应制氢氧燃料电池的氢气:BH4-+2H2O=BO2-+4H2↑(实质为水电离产生的H+被还原)。下表为pH和温度对本反应中NaBH4半衰期的影响(半衰期是指反应过程中,NaBH4的浓度降低到初始浓度一半时所需的时间)。
体系
pH
| 不同温度下NaBH4的半衰期(min)
|
0℃
| 25℃
| 50℃
| 75℃
|
8
| 4. 32 ×100
| 6. 19 ×10-1
| 8. 64 ×10-2
| 1.22 ×10-2
|
10
| 4. 32 ×102
| 6. 19 ×101
| 8. 64 ×100
| 1.22 ×100
|
12
| 4. 32 ×104
| 6. 19 ×103
| 8. 64 ×102
| 1.22 ×102
|
14
| 4. 32 ×106
| 6. 19 ×105
| 8. 64 ×104
| 1.22 ×104
|
根据要求回答下列问题:
(1)NaBH4与水反应后所得溶液显碱性,则溶液中各离子浓度大小关系为___________。
(2)从上表可知,温度对NaBH4与水反应速率产生怎样的影响?
答:
。
(3)反应体系的pH为何会对NaBH4与水反应的反应速率产生影响?
答:
。
(4)实验表明,将NaBH4溶于足量水,释放的H2比理论产量少得多(即反应一段时间后有NaBH4剩余也不再反应)。其可能原因是
。
参考答案:(1)c(Na
本题解析:
本题难度:一般