微信搜索关注"91考试网"公众号,领30元,获取公务员、事业编、教师等考试资料40G!
1、选择题 在无色透明的溶液中可以大量共存的离子组是( )
A.Mg2+、K+、Cl-、NO3-
B.H+、K+、HCO3-、NO3-
C.Cu2+、NO3-、SO42-、Cl-
D.OH-、Cl-、Na+、NH4+
参考答案:A
本题解析:B项:H+与HCO3-反应不能共存;C项:Cu2+有颜色不能共存;D项:NH4+与OH-反应不能共存。故选A。
点评:本题考查离子的共存问题,熟悉离子的性质及发生的反应是解答本题的关键,难度不大。(1)离子间相互结合形成沉淀、气体、弱电解质、络离子时不能大量共存;离子间发生双水解反应、氧化还原反应时不能大量共存。(2)注意题目的限制条件。
本题难度:一般
2、选择题 下列各组离子在溶液中大量共存,且加入(NH4)2Fe(SO4)2·6H2O晶体后仍能大量存在的是
A.Na+、H+、Cl—、NO3—
B.K+、Ba2+、OH—、I—
C.Na+、Mg2+、Cl—、SO42—
D.Cu2+、S2—、Br—、ClO—
参考答案:C
本题解析:A项,H+、NO3—和Fe2+三种离子不能共存;B项,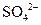 和Ba2+、OH—和
和Ba2+、OH—和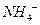 不能共存;D项,Cu2+和S2—不能共存
不能共存;D项,Cu2+和S2—不能共存
本题难度:一般
3、选择题 常温下,下列各组离子在指定溶液中能大量共存的是( )
A.pH=1的溶液中:NH+4、Na+、I-、NO-3
B.由水电离的c(H+)=1×10-14mol/L的溶液中:Ca2+、K+、Cl-、HCO3-
C.能使甲基橙变红的溶液中:NH4+、Al3+、NO3-、Cl-
D.c(Fe3+)=0.1mol/L的溶液中:K+、ClO-、SO42-、SCN-
参考答案:A.pH=1的溶液显酸性,H+、I-、NO3-离子之间发生氧化还原反应,则不能共存,故A错误;
B.由水电离的c(H+)=1×10-14mol/L的溶液,为酸或碱溶液,HCO3-既能与酸反应又能与碱反应,则不能共存,故B错误;
C.能使甲基橙变红的溶液,pH<3.1,溶液显酸性,该组离子之间不反应,能共存,故C正确;
D.Fe3+、SCN-离子之间结合生成络离子,则不能共存,故D错误;
故选C.
本题解析:
本题难度:一般
4、选择题 室温下,某溶液中水电离出的H+和OH-的物质的量浓度乘积为1×10-26,该溶液中一定不能大量存在的离子是
A.Cl-
B.HCO3-
C.Na+
D.NO3-
参考答案:B
本题解析:强酸强碱都会抑制水的电离,所以此溶液可能是强酸也可能是强碱,而碳酸氢根在强酸强碱的条件下都不共存。
点评:本题的解题关键在于如何理解某溶液中水电离出的H+和OH-的物质的量浓度乘积为1×10-26。
本题难度:一般
5、选择题 某溶液中含有NO、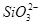 、
、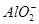 、S2-4种离子,若向其中加入过量的盐酸,微热并搅拌,再加入过量的氢氧化钠溶液,则溶液中离子数目大量减少的是
、S2-4种离子,若向其中加入过量的盐酸,微热并搅拌,再加入过量的氢氧化钠溶液,则溶液中离子数目大量减少的是
A.只有S2-
B.S2-和NO3-
C.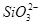 、S2-和NO3-
、S2-和NO3-
D.4种离子都减少
参考答案:B
本题解析:本题通过实验探究4种离子的反应情况,考查离子反应的本质。解答时根据H+、Cl-、Na+、OH-与4种离子的性质,推断出离子数目大量减少的离子。加入过量盐酸,NO3- (H+)氧化S2-,从而导致 NO3-和S2-的数目大量减少,而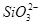 、
、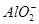 与过量的H+反应生成H2SiO3、Al3+,H2SiO3、Al3+分别与过量的OH-反应又生成
与过量的H+反应生成H2SiO3、Al3+,H2SiO3、Al3+分别与过量的OH-反应又生成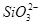 和
和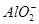 ,数目几乎不变。
,数目几乎不变。
本题难度:一般