微信搜索关注"91考试网"公众号,领30元,获取公务员、事业编、教师等考试资料40G!
1、选择题 自来水可用氯气消毒,某学生用这种自来水去配制下列物质溶液,会产生明显的药品变质问题的是
A.NaNO3
B.FeCl2
C.Na2SO4
D.AlCl3
2、选择题 下列说法正确的是 (? )
A.因SiO2不溶于水,故H2SiO3不是SiO2对应的酸,或者说SiO2不是H2SiO3的酸酐
B.CO2通入水玻璃(Na2SiO3溶液)可以得到硅酸
C.因为高温时SiO2与Na2CO3反应生成CO2,故硅酸的酸性比碳酸强
D.因为NH3·H2O是弱碱,所以不能用氨水与FeCl3溶液反应制取Fe(OH)3
3、填空题 二氧化氯(ClO2)是一种在水处理等方面有广泛应用的高效安全消毒剂。比Cl2更好。
⑴?在ClO2的制备方法中,有下列两种制备方法: ?
方法一:2NaClO3+4HCl=2ClO2↑+Cl2↑+2NaCl+2H2O ?
方法二:2NaClO3+H2O2+H2SO4=2ClO2↑+Na2SO4+O2↑+2H2O ?
用方法二制备的ClO2更适合用于饮用水消毒,其主要原因是____________?。
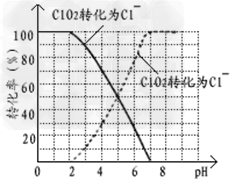
⑵?用ClO2处理过的饮用水(pH?5.5~6.5)常含有一定量对人体不利的亚氯酸根离子(ClO2-)。饮用水中的ClO2、ClO2-含量可用连续碘量法进行测定。ClO2被I-还原为ClO2-、Cl-的转化率与溶液pH的关系如下图所示。当pH≤2?.0时,ClO2-也能被I-完全还原为Cl-。反应生成的I2用标准Na2S2O3溶液滴定;2Na2S2O3+?I2=?Na2S4O6?+?2NaI
①请写出pH≤2?.0时ClO2-与I-反应的离子方程式______________。
②请完成相应的实验步骤:
步骤1:准确量取V?mL水样加入到锥形瓶中。
步骤2:调节水样的pH为7.0~8.0。
步骤3:加入足量的KI晶体。
步骤4:?加入少量淀粉溶液,用c?mol·L-1Na2S2O3溶液滴定至终点,消耗Na2S2O3溶液V1mL。
步骤5:_______________________。
步骤6:再用c?mol·L-1Na2S2O3溶液滴定至终点,消耗Na2S2O3溶液V2?mL。
③根据上述分析数据,测得该饮用水中ClO2-的浓度为___________mol·L-1(用含字母的代数式表示)。
4、实验题 右图为实验室某浓盐酸试剂瓶上的标签,试 根据有关数据回答下列问题:
根据有关数据回答下列问题:
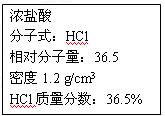
(1)该浓盐酸中HCl的物质的量浓度为?mol/L。
(2)取用任意体积的该盐酸溶液时,下列物理量中不随所取体积的多少而变化的是?。
A.溶液中HCl的物质的量? B.溶液的浓度
C.溶液中Cl-的数目? ?D.溶液的密度
?D.溶液的密度
(3)某学生欲用上述浓盐酸和蒸馏水配制500 mL物质的量浓度为0.30 mol/L稀盐酸。
①该学生需要量取?mL上述浓盐酸进行配制。
②配制时,其正确的操作顺序是(用字母表示,每个字母只能用一次) ??。
A.用30 mL水洗涤烧杯2~3次,洗涤液均注入容量瓶,轻轻摇动容量瓶
B.用量筒准确量取所需浓盐酸的体积,慢慢沿杯壁注入盛有少量水(约30 mL)的烧杯中,用玻璃棒慢慢搅动,使其混合均匀
C.将已冷却的盐酸沿玻璃棒注入500 mL的容量瓶中
D.将容量瓶的玻璃塞盖紧,颠倒摇匀
E.改用胶头滴管加水,使溶液凹面恰好与刻度线相切
F.继续往容量瓶内小心加水,直到液面接近刻度线1~2 cm处
③在配制过程中,下列操作会使所配制的稀盐酸物质的量浓度偏高的是?。
A.用量筒量取浓盐酸时俯视观察凹液面
B.溶液注入容量瓶前没有恢复到室温就进行定容
C.定容时仰视刻度线
D.在配置前用已知浓度的稀盐酸润洗容量瓶
(4)现将200 mL 0.30 mol/L的盐酸与50 mL 0.80 mol/L CaCl2溶液混合(体积变化忽略不计),所得溶液中Cl-的物质的量浓度是? mol/L;向所得混合溶液中加入5.3 g Na2CO3固体,充分反应后,溶液中生成沉淀的质量有_________g。
(5)在标准状况下,将______________L HCl气体溶于1000 mL水中(水的密度为1 g/cm3),所得盐酸的密度为1.2 g/cm3,溶质质量分数为36.5% 。(保留小数点后一位)
5、选择题 下列说法正确的是(?)
A.非金属元素R所形成的含氧酸盐(NaROb)中的R元素必定呈现正价
B.只有非金属能形成含氧酸或含氧酸盐
C.除稀有气体外的非金属元素都能生成不同价态的含氧酸
D.非金属的最高价含氧酸都具有强氧化性