微信搜索关注"91考试网"公众号,领30元,获取公务员、事业编、教师等考试资料40G!
1、选择题 下列有关0.1 mol·L-1 NaHCO3溶液中离子浓度的关系式,正确的是
[? ]
A.c(Na+) > c(HCO3-) > c(CO32-) > c(H+) > c(OH-)
B.c(Na+) > c(CO32-) > c(HCO3-) > c(OH-) > c(H+)
C.c(Na+)= c(HCO3-) + 2c(CO32-) + c(H2CO3)
D.c(Na+) + c(H+)?= c(HCO3-) + 2c(CO32-) + c(OH-)
参考答案:D
本题解析:
本题难度:一般
2、填空题 (1)在25℃条件下将pH=11的氨水稀释100倍后溶液的pH为______________(填序号)。
A.9 B.13 C.11~13之间 D.9~11之间
(2)25℃时,向0.1mol/L的氨水中加入少量氯化铵固体,当固体溶解后,测得溶液pH减小,主要原因是(填序号)______________。
A.氨水与氯化铵发生化学反应
B.氯化铵溶液水解显酸性,增加了c(H+)
C.氯化铵溶于水,电离出大量铵离子,抑制了氨水的电离,使c(OH-)减小
(3)室温下,如果将0.1mol NH4Cl和0.05mol NaOH全部溶于水,形成混合溶液(假设无损失),
①_________和__________两种粒子的物质的量之和等于0.1mol。
②_________和__________两种粒子的物质的量之和比OH-多0.05mol。
(4)已知某溶液中只存在OH-、H+、NH4+、Cl-四种离子,某同学推测该溶液中各离子浓度大小顺序可能有如下四种关系
A.c(Cl-)>c(NH4+)>c(H+)>c(OH-)
B.c(Cl-)>c(NH4+)>c(OH-)>c(H+)
C.c(Cl-)>c(H+)>c(NH4+)>c(OH-)
D.c(NH4+)>c(Cl-)>c(OH-)>c(H+)
① 若溶液中只溶解了一种溶质,该溶质的名称是____________,上述离子浓度大小顺序关系中正确的是
______________(选填序号) 。
② 若上述关系中C是正确的,则溶液中溶质的化学式是______________。
③ 若该溶液中由体积相等的稀盐酸和氨水混合而成,且恰好呈中性,则混合前c(HCl)__________(填“>”、“<”、或“=”,下同) c(NH3·H2O),混合后溶液中c(NH4+)与c(Cl-)的关系c(NH4+)
___________ c(Cl-)。
参考答案:(1)D
(2)C
(3)①NH3·H2O;NH4+;②NH4+;H+
(4)①氯化铵;A;②NH4Cl、HCl;③<;=
本题解析:
本题难度:一般
3、简答题 某温度下0.1mol/L?Na2CO3溶液中,[Na+]/[CO32-]=20/9>2,其原因是______,现向Na2CO3溶液中通入一定量的CO2后,[Na+]/[CO32-]=5/2>20/9,其原因是______,此时[HCO3-]=______.
参考答案:Na2CO3溶液中,CO32-发生水CO32-+H2O═HCO3+OH-,CO32-与CO2、H2O反应:CO32-+CO2+H2O═2HCO3-,Na2CO30.1mol/L 中,[?N+a?]?[CO32-?]=209=2.5,c(Na+)=0.2mol/L,所以c(CO32-)=0.08mol/L,c(HCO3-)=2×(0.1-0.08)mol/L=0.04mol/L.
?故答案为:CO32-发生水解;CO32-与CO2、H2O反应,导致c(CO32-)降低;0.04mol/L.
本题解析:
本题难度:一般
4、选择题 下列说法正确的是
[? ]
A.?用甘氨酸(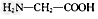 )和丙氨酸(
)和丙氨酸(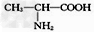 )缩合最多可形成4种二肽
)缩合最多可形成4种二肽
B.?0.1?mol/L?Na2S溶液中:c(OH-)=?c(H+)+?c(HS-)+?c(H2S)
C.?标准状况下,2.24L己烷含有分子的数目为0.1NA
D.?由离子方程式 +?XO3-?+?6H+?==?3X2?+?3H2O可判断X元素的最高化合价为+5价
+?XO3-?+?6H+?==?3X2?+?3H2O可判断X元素的最高化合价为+5价
参考答案:A
本题解析:
本题难度:一般
5、填空题 现有浓度均为0.1?mol/L的下列溶液:①硫酸、②醋酸、③氢氧化钠、④氯化铵、⑤醋酸铵、⑥硫酸铵、⑦硫酸氢铵、⑧氨水,请回答下列问题:
(1)①、②、③、④四种溶液中由水电离出的H+浓度由大到小的顺序是(填序号)______.
(2)④、⑤、⑦、⑧四种溶液中NH4+浓度由大到小的顺序是(填序号)______.
(3)将①和⑧等体积混合后,混合液中各离子浓度关系正确的是______.
A.c(H+)>c(SO42- )>c(NH4+)>c(OH-)
B.c(H+)=c(SO42- )=c(NH4 +)>c(OH-)
C.c(NH4+ )>c(H+)=c(SO42- )>c(OH-)
D.c(OH-)>c(H+)>c(NH4+)=c(SO42- )
参考答案:(1)这四种溶液中,其中①、②、③对水的电离起到抑制作用,只有④对水的电离起到促进作用,所以④中H+浓度大,由水的离子积可计算①中C(H+)=5×10-14mol/L、②C(H+)>10-13mol/L、③C(H+)=10-13mol/L,所以四种溶液中由水电离出的H+浓度由大到小的顺序是④②③①,故答案为:④②③①;
(2)⑧为弱电解质的水溶液,NH4+离子浓度最小,⑦中H+浓度最大,NH4+的水解程度最小,NH4+浓度最大,⑤醋酸铵为弱酸弱碱盐,Ac-与NH4+发生互促水解,浓度最小,则)④、⑤、⑦、⑧四种溶液中NH4+浓度由大到小的顺序是⑦④⑤⑧,故答案为:⑦④⑤⑧;
(3)将①和⑧等体积混合,反应后的溶液为NH4HSO4,溶液呈酸性,则D错误,存在的NH4+的水解,则c(SO42- )>c(NH4+),所以B、C错误,
故答案为:A.
本题解析:
本题难度:一般