微信搜索关注"91考试网"公众号,领30元,获取公务员、事业编、教师等考试资料40G!
1、填空题 (13分) 2SO2(g)+O2(g) =2SO3(g)反应过程的能量变化如图所示。已知1mol SO2(g)氧化为1mol SO3的 ΔH=—99kJ·mol-1.请回答下列问题:
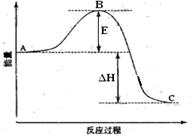
 (1)图中A、C分别表示 、
(1)图中A、C分别表示 、
(2) E的大小对该反应的反应热有无影响? 。该反应通常用V2O5作催化剂,加V2O5会使图中B点升高还是降低?
 (3)图中△H= KJ·mol-1;
(3)图中△H= KJ·mol-1;
 (4)V2O5的催化循环机理可能为:V2O5氧化SO2时,自身被还原为四价钒化合物;四价钒化合物再被氧气氧化。写出该催化循环机理的化学方程式:
(4)V2O5的催化循环机理可能为:V2O5氧化SO2时,自身被还原为四价钒化合物;四价钒化合物再被氧气氧化。写出该催化循环机理的化学方程式:
、
 (5)已知单质硫的燃烧热为296 KJ·mol-1,计算由S(s)生成3 molSO3(g)的△H (要求写出计算过程)。
(5)已知单质硫的燃烧热为296 KJ·mol-1,计算由S(s)生成3 molSO3(g)的△H (要求写出计算过程)。
参考答案:(1)反应物能量 生成物能量
(2)无 降低 因为催化剂改变了反应的历程使活化能E降低
(3)-198
(4)SO2+V2O5=SO3+2VO2 4VO2+O2=2V2O5 0.025 0.05
(5)-1185kJmol-1
本题解析: (1)根据图像可知,反应物总能量高于生成物总能量,所以为放热反应,由此可得到A和C所表示的意义,E为活化能与反应热无关,但是用催化剂可以降低活化能;
(1)根据图像可知,反应物总能量高于生成物总能量,所以为放热反应,由此可得到A和C所表示的意义,E为活化能与反应热无关,但是用催化剂可以降低活化能;
(2)图中表示的是2molSO2的反应,因此△H=-99×2KJ·mol-1;
(3)依题意即可写出:SO2 +V2O5=SO3+2VO2 4VO2+ O2=2V2O5;
(4)依据速率之比等于化学计量数之比计算即可。
(5)根据题意①S(s)+O2(g) =SO2(g) △H= —296KJ/mol,又因为②SO2(g)+1/2O2(g) =SO3(g) △H= —99kJ/mol。根据盖斯定律可知①+②即得到S(s)+3/2O2(g) =SO3(g) △H= —395KJ/mol,所以由S(s)生成3 molSO3(g)的△H=—395KJ/mol×3=-1185kJmol-1。
本题难度:一般
2、选择题 在下列变化过程中,既有离子键被破坏又有共价键被破坏的是( )
A.将SO2通入水中
B.烧碱溶于水
C.将HCl通入水中
D.硫酸氢钠溶于水
参考答案:A、二氧化硫和水反应生成亚硫酸,只有共价键被破坏和形成,故A错误.
B、烧碱溶于水后电离出钠离子和氢氧根离子,只有离子键被破坏,故B错误.
C、氯化氢溶于水后电离出氢离子和氯离子,只有共价键被破坏,故C错误.
D、硫酸氢钠溶于水后电离出氢离子、钠离子和硫酸根离子,钠离子和硫酸氢根离子之间的离子键被破坏,硫酸氢根离子中氧原子和氢原子之间的共价键被破坏,所以既有离子键被破坏又有共价键被破坏,故D正确.
故选D.
本题解析:
本题难度:一般
3、选择题 下列变化中,不需要破坏化学键的是( )
A.氯化氢溶于水
B.浓硝酸见光分解
C.冰雪融化
D.氯化钠熔化
参考答案:A.氯化氢溶于水时H-Cl共价键被破坏,故A不选;
B.浓硝酸见光分解发生化学反应,所以化学键一定被破坏,故B不选;
C.冰雪融化需克服分子间作用力,而化学键没有变化,故C选;
D.氯化钠熔化时破坏离子键,故D不选;
故选C.
本题解析:
本题难度:简单
4、填空题 写出下列物质的电子式(4分)
H2O? 1??KOH? 2??
CO2:? 3??Na2O2:? 4?
参考答案:1?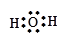 ?2?
?2? ?3?
?3?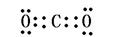 ?4?
?4?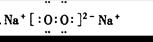
本题解析:1、为共价化合物,把元素最外层电子标出,共用电子对写在原子之间。2、离子化合物,注意有两个化学键,共价键和离子键。3、二氧化碳为共价化合物,碳和氧之间有两对共用电子对。4、过氧化钠的写法中,难点在于把过氧根离子写好。
点评:本题涉及到了常见物质的电子式的书写,离子化合物的电子式的书写注意阳离子的电子式为阳离子本身,而阴离子需要标出最外层所有的电子并打括号,带上电荷。共价化合物的电子式不带电荷,不打括号。
本题难度:一般
5、填空题 化学反应中的能量变化,是由化学反应中旧化学键断裂时吸收的能量与新化学键形成时放出的能量不同所致。下图为N2 (g)和O2 (g) 生成NO(g)过程中的能量变化:?

(1)人们通常把拆开1mol某化学键所吸收的能量看成该化学键的键能。键能的大小可以衡量化学键的强弱,则N三N键的键能为___________kJ·mol-1。根据上图图写出N2(g)和O2 (g)生成NO(g)的热化学方程式:_________________。
(2)NO(g)分解生成N2(g)和O2(g)的热化学方程式为 ________________;当有16g O2 (g)生成时,该反应中放出的热量为_____________kJ。
参考答案:(1)946 ;N2(g)+O2(g)=2NO(g) △H= +180kJ·mol-1
(2)2NO(g)=N2(g)+O2(g)△H=-180 kJ·mol-1 ;90
本题解析:
本题难度:一般