微信搜索关注"91考试网"公众号,领30元,获取公务员、事业编、教师等考试资料40G!
1、选择题 下列实验操作不能达到其对应目的的是
序号
| 实验内容
| 实验目的
|
A.
| 向盛有10滴0.1 mol/L AgNO3溶液的试管中滴加0.1 mol/L NaCl溶液,至不再有沉淀生成,再向其中滴加0.1 mol/L Na2S溶液
| 证明AgCl沉淀能转化为溶解度更小的Ag2S沉淀
|
B.
| 向2 mL甲苯中加入3滴KMnO4酸性溶液,振荡;向2mL己烷中加入3滴KMnO4酸性溶液,振荡
| 证明与苯环相连的甲基易被氧化
|
C.
| 向Na2SiO3溶液中通入CO2
| 证明碳酸的酸性比硅酸强
|
D.
| 在淀粉溶液中加入稀硫酸,水浴加热,一段时间后,再加入新制的氢氧化铜并加热
| 验证淀粉已水解
2、计算题 难溶化合物的饱和溶液存在溶解平衡,例如:AgCl(s)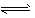 Ag(sq)+Cl(aq), Ag(sq)+Cl(aq),
Ag2CrO4(s)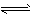 2Ag(aq)+CrO42-(aq),一定温度下,其离子浓度乘积为常数,这一常数叫溶度积常数,用Ksp表示,已知: 2Ag(aq)+CrO42-(aq),一定温度下,其离子浓度乘积为常数,这一常数叫溶度积常数,用Ksp表示,已知:
Ksp(AgCl)=c(Ag)·c(Cl-)=1.8×10 -10,
Ksp(Ag2CrO4)=c2(Ag+)·c(CrO42-)=1.9×10-12,
现用0. 01mol/L的AgNO3溶液溶液滴定0. 01mol/L的KCl和0.001mol/L K2CrO4混合溶液,通过计算回答:
(1) Cl-、CrO42-谁先沉淀?
(2)当刚出现Ag2CrO4沉淀时,溶液中Cl-浓度是多少?(设混合溶液在反应中体积不变)(已知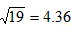 ) )
3、填空题 已知氨水与醋酸的电离程度在同温同浓度下相等,溶有一定量氨的氯化铵溶液呈碱性。现向少量的Mg(OH)2悬浊液中加入适量的饱和氯化铵溶液,固体完全溶解。
甲同学的解释是:
Mg(OH)2(s) Mg2+(aq)+2OH-(aq)① Mg2+(aq)+2OH-(aq)①
N+H2O NH3·H2O+H+② NH3·H2O+H+②
H++OH- H2O③ H2O③
由于N水解显酸性,H+与OH-反应生成水,导致反应①平衡右移,沉淀溶解;
乙同学的解释是:
Mg(OH)2(s) Mg2+(aq)+2OH-(aq)① Mg2+(aq)+2OH-(aq)①
N+OH- NH3·H2O② NH3·H2O②
由于NH4Cl电离出的N与Mg(OH)2电离出的OH-结合,生成了弱电解质NH3·H2O,导致反应①的平衡右移,Mg(OH)2沉淀溶解。
(1)丙同学不能肯定哪位同学的解释合理,于是选用下列的一种试剂,来证明甲、乙两位同学解释只有一种正确,他选用的试剂是 (填写编号)。?
A.NH4NO3
B.CH3COONH4
C.Na2CO3
D.NH3·H2O
|
(2)请你说明丙同学作出该选择的理由是 。?
(3)丙同学将所选试剂滴入Mg(OH)2悬浊液中,Mg(OH)2溶解;由此推知,甲和乙哪位同学的解释更合理 (填“甲”或“乙”);写出NH4Cl饱和溶液使Mg(OH)2悬浊液溶解的离子方程式 。?
4、选择题 氯化银在水中存在沉淀溶解平衡,25℃时,氯化银的Ksp=1.8×10-10.现将足量氯化银分别放入:①5mL蒸馏水中;②20mL0.2mol?L-1MgCl2中;③10mL0.5mol?L-1NaCl溶液中,充分搅拌后,在相同温度下,c(Ag+)由大到小的顺序是( )
A.①②③
B.③②①
C.②①③
D.②③①
5、选择题 已知25℃时,AgC1、AgBr、Agl的Ksp分别为1.8×l0-l0、5.O×10—13、8.3×10—17,用AgNO3标准溶液滴定卤素离子的过程,以滴入AgNO3溶液的体积为横坐标,pX为纵坐标:[pX= -lgc(X )],就可绘得滴定曲线。现以0.1 mol·L-l AgNO3溶液分别滴定20.00 mL 0.1 mol·L-lCl
)],就可绘得滴定曲线。现以0.1 mol·L-l AgNO3溶液分别滴定20.00 mL 0.1 mol·L-lCl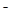 、Br
、Br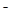 、I
、I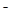 绘得滴定曲线如图,下列有关说法中正确的是
绘得滴定曲线如图,下列有关说法中正确的是

A.a、b、c分别表示Cl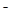 、Br
、Br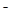 、I
、I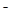
B.a、b、c分别表示I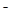 、Br
、Br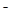 、Cl
、Cl
C.a、b、c分别表示Br 、I
、I 、Cl
、Cl
D.用硝酸银滴定法测定试样中c(Cl ),可用KI作指示剂
),可用KI作指示剂