|
|
|
高考化学必考知识点《化学平衡》高频试题强化练习(2017年最新版)(四)
2017-07-27 08:51:12
来源:91考试网
作者:www.91exam.org 【 大 中 小】
|
微信搜索关注"91考试网"公众号,领30元,获取公务员、事业编、教师等考试资料40G!
1、填空题 (10分)t℃时,将3molA和2molB气体通入体积为2L的密闭容器中(容积不变),发生如下反应:3A (g)+B (g) x C(g),2min时反应达到平衡状态(温度不变),剩余1.8molB,并测得C的浓度为0.4mol/L,请填写下列空白: x C(g),2min时反应达到平衡状态(温度不变),剩余1.8molB,并测得C的浓度为0.4mol/L,请填写下列空白:
(1)v(B) = mol/(L·min),v(C) = mol/(L·min),x= 。
(2)比较达到平衡时,A、B两反应物的转化率之比为α(A):α(B)= ;
(3)若继续向原平衡混合物的容器中通入少量氦气(氦气和A、B、C都不反应)后,下列说法中正确的是____________(填写字母序号)
A.化学平衡向正反应方向移动 B.化学平衡向逆反应方向移动
C.化学平衡不会发生移动 D.正、逆反应的化学反应速率保持不变
参考答案:(10分)
(1)0.05 0.2 x=4
(2) 2:1 (3)C、D
本题解析:略
本题难度:简单
2、填空题 研究NO2、SO2、CO等大气污染气体的处理具有重要意义。
(1)已知:2SO2(g)+O2(g) 2SO3(g) ΔH= -196.6kJ·mol-1 2SO3(g) ΔH= -196.6kJ·mol-1
2NO(g)+O2(g) 2NO2(g) ΔH= -113.0kJ·mol-1 2NO2(g) ΔH= -113.0kJ·mol-1
则反应NO2(g)+SO2(g) SO3(g)+NO(g)的ΔH= kJ·mol-1。 SO3(g)+NO(g)的ΔH= kJ·mol-1。
(2)一定条件下,将NO2与SO2以体积比2∶1置于密闭容器中发生上述反应,下列能说明反应达到平衡状态的是 。
A.体系压强保持不变
B.混合气体颜色保持不变
C.SO3和NO的体积比保持不变
D.每消耗1molSO3的同时生成1mol NO
| 若测得上述反应达平衡时NO2与SO2的体积比为5∶1,则平衡常数K= 。
(3)CO可用于合成甲醇,反应方程式为CO(g)+2H2(g) CH3OH(g)。CO在不同温度下的平衡转化率与压强的关系如图甲所示。该反应ΔH________0(填“>”或“<”)。 CH3OH(g)。CO在不同温度下的平衡转化率与压强的关系如图甲所示。该反应ΔH________0(填“>”或“<”)。
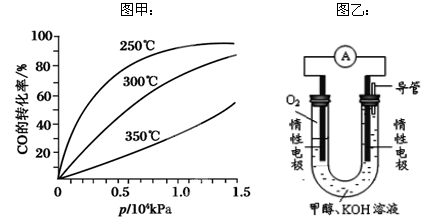
(4)依据燃烧的反应原理,合成的甲醇可以设计如图乙所示的原电池装置。
① 该电池工作时,OH-向 极移动(填“正”或“负”)。
② 该电池正极的电极反应式为 。
参考答案:(1)-41.8 (2)BD 1.8 (3)< (4)负 2H2O+O2+4e-=4OH-
本题解析:(1)2SO2(g)+O2(g) 2SO3(g) ΔH= -196.6kJ·mol-1 ①,2NO(g)+O2(g) 2SO3(g) ΔH= -196.6kJ·mol-1 ①,2NO(g)+O2(g) 2NO2(g) ΔH= -113.0kJ·mol-1 ②, 2NO2(g) ΔH= -113.0kJ·mol-1 ②,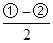 得出:NO2(g)+SO2(g) 得出:NO2(g)+SO2(g) SO3(g)+NO(g)的ΔH= SO3(g)+NO(g)的ΔH=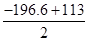 kJ·mol-1=-41.8kJ·mol-1;A、反应前后气体系数相同,反应的任何时刻压强都想等,不能作为达到化学平衡的标志;B、NO2红棕色气体,其他的气体都是无色气体,颜色不变说明达到了化学平衡,正确;C、SO3、NO都是生成物且系数相等,任何时刻,SO3和NO的比值都相等,不能作为达到化学平衡的标志,错误;D、消耗1molSO3,生成1molNO,反应的方向相反,速率之比等于系数之比,能作为达到化学平衡的标志,正确,因此BD正确; 设消耗的NO2的物质的量为xmol, kJ·mol-1=-41.8kJ·mol-1;A、反应前后气体系数相同,反应的任何时刻压强都想等,不能作为达到化学平衡的标志;B、NO2红棕色气体,其他的气体都是无色气体,颜色不变说明达到了化学平衡,正确;C、SO3、NO都是生成物且系数相等,任何时刻,SO3和NO的比值都相等,不能作为达到化学平衡的标志,错误;D、消耗1molSO3,生成1molNO,反应的方向相反,速率之比等于系数之比,能作为达到化学平衡的标志,正确,因此BD正确; 设消耗的NO2的物质的量为xmol,
NO2(g)+SO2(g) SO3(g)+NO(g) SO3(g)+NO(g)
起始: 2 1 0 0
变化: x x x x
平衡:2-x 1-x x x
根据题意: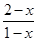 =5:1,解得x= =5:1,解得x=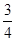
K=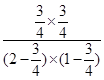 =1.8 =1.8
(3)根据图像随温度的升高CO的转化率降低,说明升高温度,平衡左移,正反应方向是放热反应,△H<O;(4)根据原电池的工作原理:阴离子向负极移动,阳离子向正极移动,①OH-向负极移动;②燃料电池甲醇在负极上反应,氧气在正极上的电子,溶液是碱性溶液,正极反应式: 2H2O+O2+4e-=4OH-
考点:考查热化学反应方程式的计算、达到化学平衡的标志、平衡常数的计算、原电池的工作原理。
本题难度:困难
3、选择题 已知反应A(g)+B(g) nC(g) △H=x kJ·mol-1,在不同条件下进行时,混合物中C的百分含量随时间变化的关系如图。 nC(g) △H=x kJ·mol-1,在不同条件下进行时,混合物中C的百分含量随时间变化的关系如图。
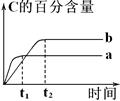
下列有关叙述一定正确的是
A.a条件下的反应速率小于b条件下的反应速率
B.其他条件相同时,a表示有催化剂,b表示无催化剂
C.其他条件相同,若a、b表示不同压强下的反应,则n>2
D.其他条件相同,若a、b表示不同温度下的反应,则x>0
|
参考答案:C
本题解析:
试题分析:A、a达到平衡所用的时间短,故a的反应速率快,A错误;B、加入催化剂反应速率增大,平衡不发生移,B错误;C.a到达平衡时间短,所以a压强高,压强越大,平衡时C的百分含量(C%)越小,可知正反应为气体物质的量增大的反应,即1<n,所以a比b的压强大且n>2,故C正确;D、a的反应速率快,故温度高,说明升高温度,平衡向逆反应方向移动,反应为放热反应,x<0,D错误;故选C.
考点:化学平衡的影响因素
本题难度:一般
4、选择题 在一恒容密闭烧瓶中,25℃时存在平衡:2NO2(g)  N2O4(g) △H<0。将烧瓶置于100℃的水中,则下列物理量中不会改变的是
N2O4(g) △H<0。将烧瓶置于100℃的水中,则下列物理量中不会改变的是
A.颜色
B.密度
C.N2O4的浓度
D.压强
参考答案:B
本题解析:可逆反应2NO2?N2O4,正反应为放热反应,升高温度,化学平衡向着逆反应方向移动,A、二氧化氮的浓度增大,颜色加深,A不符合;B、反应混合物都是气体,根据质量守恒定律,混合气体总的质量不变,容器的容积不变,根据ρ=mV可知,混合气体的密度不变,B符合;C、升高温度,化学平衡向着逆反应方向移动,二氧化氮气体浓度增大,N2O4的浓度减小,C不符合;D、升高温度,化学平衡向左移动,混合气体总的物质的量增大、混合气体的温度升高,容器的容积不变,根据pV=nRT可知,容器内压强增大,D不符合;答案选B。
考点:考查化学平衡的影响因素。
本题难度:一般
5、选择题 实验证明:若用电解熔融KCl制钾,发现钾熔于熔融KCl中难分离,且电解过程中容易发生爆炸事故等。因而工业不用电解熔融KCl制钾,而用金属钠与KCl共熔置换制钾:
Na(l)+KCl(l) NaCl(l)+K(g) △H>0。 下面是四种物质的熔沸点:
NaCl(l)+K(g) △H>0。 下面是四种物质的熔沸点:
| K
| Na
| KCl
| NaCl
|
熔点/℃
| 63.6
| 97.8
| 770
| 801
|
沸点/℃
| 774
| 882.9
| 1500
| 1413
|
根据平衡移动原理,可推知用Na与KCl反应制取金属钾的适宜温度是
A.低于770℃ B.约850℃ C.高于882.9℃ D.1413~1500℃
参考答案:
本题解析:
本题难度:一般
 CH3OH(g)。CO在不同温度下的平衡转化率与压强的关系如图甲所示。该反应ΔH________0(填“>”或“<”)。
CH3OH(g)。CO在不同温度下的平衡转化率与压强的关系如图甲所示。该反应ΔH________0(填“>”或“<”)。
 N2O4(g) △H<0。将烧瓶置于100℃的水中,则下列物理量中不会改变的是
N2O4(g) △H<0。将烧瓶置于100℃的水中,则下列物理量中不会改变的是 NaCl(l)+K(g) △H>0。 下面是四种物质的熔沸点:
NaCl(l)+K(g) △H>0。 下面是四种物质的熔沸点: