|
高中化学知识点大全《化学实验》高频考点特训(2017年练习版)(四)
2017-07-27 08:53:21
来源:91考试网
作者:www.91exam.org 【 大 中 小】
|
微信搜索关注"91考试网"公众号,领30元,获取公务员、事业编、教师等考试资料40G!
1、实验题 (6分)实验室欲配制250mL 0.2 mol·L-1的碳酸钠溶液,回答下列问题:
可供选择的仪器:①量筒②胶头滴管③托盘天平④药匙⑤烧瓶⑥烧杯
(1)通过计算可知,应用托盘天平称取?g碳酸钠晶体(Na2CO3?10H2O)。
(2)配制过程需要的仪器______________(填序号),还缺少的仪器有?。
(3)配制时,正确的操作顺序是(用字母表示,每个字母只能用一次)_____________;
A.用30mL水洗涤烧杯2~3次,洗涤液均注入容量瓶
B.用托盘天平准确称取所需的Na2CO3固体的质量,放入烧杯中,再加入少量水(约30mL),用玻璃棒慢慢搅动,使其充分溶解
C.将已冷却的溶液沿玻璃棒注入250mL的容量瓶中
D.将容量瓶盖紧,振荡,摇匀
| E.改用胶头滴管加水,使溶液凹面恰好与刻度相切
F.继续往容量瓶内小心加水,直到液面接近刻度1~2cm处
(4)若出现如下情况,对所配溶液浓度将有何影响(填“偏高”、“偏低”或“无影响”)。若没有进行A操作______________;若定容时俯视刻度线_______________。
参考答案:(1)? 14.3g?(2)?②③④⑥,? 250mL容量瓶(没有容积不得分)、玻璃棒。
(3)? BCAFED?(4)?偏低;?偏高
本题解析:考查一定物质的量浓度的配制。
(1)200mL 0.2 mol·L-1的碳酸钠溶液中碳酸 钠的物质的量是0.25L×0.2mol/L=0.05mol,所以需要Na2CO3?10H2O的物质的量也是0.05mol,其质量是0.05mol×286g/mol=14.3g。
(2)固体需要溶解,所以需要的仪器是②③④⑥。还需要250mL容量瓶.
(3)根据配制过程可知顺序是BCAFED。
(4)如果不洗涤烧杯,则溶质的量就偏低,结果就偏低。若定容时俯视刻度线,则容量瓶中的溶液的体积就小于250ml,则测定结果就偏高。
本题难度:一般
2、选择题 下列实验操作正确的是(? ) 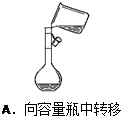 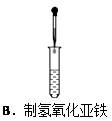 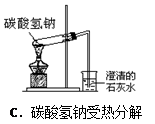 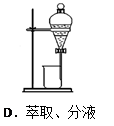
参考答案:D
本题解析:A不正确,应该用玻璃棒引流;B不正确,在制备氢氧化亚铁时滴管应该插入到溶液中,以防止氢氧化亚铁被氧化;C中试管应该是试管底要高于试管口,所以正确的答案选D。
点评:化学实验常用仪器的使用方法和化学实验基本操作是进行化学实验的基础,对化学实验的考查离不开化学实验的基本操作,该题重点考查实验基本操作的规范性和准确性,及灵活运用知识解决实际问题的能力,该题是中等难度的试题。
本题难度:一般
3、选择题 下列物质中属于电解质的是
A.食盐水
B.石墨
C.硫酸铜
D.乙醇
参考答案:C
本题解析:分析:在水溶液里或熔融状态下能导电的化合物是电解质,在水溶液里或熔融状态下都不导电的化合物是非电解质.
解答:在水溶液里或熔融状态下能导电的化合物是电解质,在水溶液里或熔融状态下都不导电的化合物是非电解质.
A.食盐水是混合物,所以不是电解质,故A错误;
B.石墨是单质,所以石墨既不是电解质也不是非电解质,故B错误;
C.硫酸铜在水溶液里能电离出自由移动的阴阳离子导致溶液导电,所以硫酸铜是电解质,故C正确;
D.乙醇在水溶液里或熔融状态下都不导电,属于非电解质,故D错误.
故选C.
点评:本题考查了电解质的判断,难度不大,注意电解质和非电解质都必须是化合物,单质和混合物既不是电解质也不是非电解质.
本题难度:简单
4、实验题 (10分)(1)实验室有下列仪器:
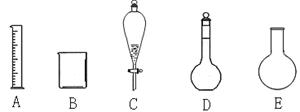
请从上述仪器中选择适当的仪器按要求填空。
(a)分离两种互不相溶的液体的仪器是__?(填字母)。
(b)配制250ml0.1 mol·L-1的盐酸需要用到的仪器是_?(填字母)。
(c)常用作配制一定物质的量浓度的仪器是_? _?(填仪器名称)。
(d)若定容时加蒸馏水液面没到刻度线,溶液浓度将_?(偏高、偏低、无影响)。
(2)在淀粉碘化钾溶液中通入少量氯气,立即会看到溶液变蓝色,这是因为_______________________________________________(请用化学方程式辅以简要文字进行解释)
参考答案:(10分,每空2分)(a) C? (b) ABD (c) 容量瓶(d)偏低
(2)碘化钾被氯气氧化生成了单质碘,反应的离子方程式是Cl2+2I-=2Cl-+I2。
本题解析:(1)分离两种互不相溶的液体的仪器是分液漏斗,答案选C;配制250ml0.1 mol·L-1的盐酸需要用到的仪器有炼铁、烧杯和容量瓶,所以答案选ABD;常用作配制一定物质的量浓度的仪器是容量瓶;根据c=n/V可知,若定容时加蒸馏水液面没到刻度线,则溶液的体积偏大,溶液浓度将偏低。
(2)碘遇淀粉显蓝色,这说明反应中碘化钾被氯气氧化生成了单质碘,反应的离子方程式是Cl2+2I-=2Cl-+I2。
点评:根据cB=nB/V可得,一定物质的量浓度溶液配制的误差都是由溶质的物质的量nB和溶液的体积V引起的。误差分析时,关键要看配制过程中引起n和V怎样的变化。在配制一定物质的量浓度溶液时,若nB比理论值小,或V比理论值大时,都会使所配溶液浓度偏小;若nB比理论值大,或V比理论值小时,都会使所配溶液浓度偏大。
本题难度:一般
5、选择题 碳酸钙常用作牙膏的摩擦剂.某同学设计了一种制备碳酸钙的方案,其流程图如下:(所用石灰石含有杂质SiO2)

回答下列问题:
(1)充分煅烧110吨石灰石得到固体66吨.标准状况下生成二氧化碳的体积为?L,石灰石中碳酸钙的质量分数为?%.
(2)假设第①步反应完全进行,则第②步反应过滤后得到的不溶性滤渣的成分为?.
(3)第③步反应一般不采用通入CO2的主要原因是?,相应的离子方程式为?.
(4)CaCO3是一种难溶液物质,25℃时其KSP=2.8×10-9.现将等体积的CaCl2溶液与Na2CO3溶液混合,若Na2CO3溶液的浓度为2.0×10-4mol/L,则生成沉淀所需CaCl2溶液的物质的量浓度最小是?.
(5)某学生用石灰石为原料,设计了另一种制备碳酸钙的实验方案,其流程图如下:

与前一方案相比较,该方案的优点是?.
参考答案:(每空2分,共14分)
(1)2.24×107L ;?90.0?(4分)
(2)CaSiO3?(2分)
(3)通入CO2的量不易控制,使生成的碳酸钙在CO2过量的条件下溶解 (2分)
CaCO3+CO2+H2O=Ca2++2HCO3—?(2分)
(4)5.6×105mol/L?(2分)
(5)不需要加热,操作简单,减少来自燃料的污染(2分)
本题解析:
(1) 根据碳酸钙分解: 根据碳酸钙分解:
CaCO3 CaO? + ?CO2 ↑?△m CaO? + ?CO2 ↑?△m
100? 56? 22.4 ?44
100×106g?V ?44×106g
所以生成二氧化碳的体积为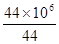 mol×22.4L/mol=2.24×107L mol×22.4L/mol=2.24×107L
石灰石中碳酸钙的质量分数为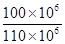 ?×100%=90.9% ?×100%=90.9%
(2)碳酸钙除了分解,还与少量杂质SiO2发生反应:SiO2+CaCO3=CaSiO3+CO2
所以不溶液性滤渣的成分有CaSiO3。
(3)因CO2过量时,会继续与碳酸钙反应,CaCO3+CO2+H2O═Ca2++2HCO3-(4)当溶液中QC≥KSP时,形成沉淀,C(Ca2+)≥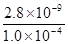 mol?L-1=2.8×10-5mol?L-1, mol?L-1=2.8×10-5mol?L-1,
等体积混合前CaCl2溶液的物质的量浓度最小为5.6×10-5?mol?L-1
(5)因与前一方案相比较,可知制备过程不需要加热、操作简便等。
本题难度:一般
|