|
高考化学知识点归纳《影响盐类水解的因素》试题预测(2017年最新版)(二)
2017-07-27 08:55:09
来源:91考试网
作者:www.91exam.org 【 大 中 小】
|
微信搜索关注"91考试网"公众号,领30元,获取公务员、事业编、教师等考试资料40G!
1、实验题 (8分)常温下,将某一元酸HA和NaOH溶液等体积混合,两种溶液的浓度和混合后所得溶液的pH如下表:
实验
编号
| HA物质的量
浓度(mol·
L-1)
| NaOH物质的
量浓度(mol·
L-1)
| 混合溶液的
pH
| 甲
| 0.2
| 0.2
| pH=a
| 乙
| c1
| 0.2
| pH=7
| 丙
| 0.2
| 0.1
| pH>7
| 丁
| 0.1
| 0.1
| pH=9
|
请回答:
(1)不考虑其他组的实验结果,单从甲组情况分析,
若a________7(填“>”、“<”或“=”),则HA为强酸;
若a________7(填“>”、“<”或“=”),则HA为弱酸。
(2)在乙组中混合溶液中离子浓度c(A-)与c(Na+)的大小关系是( )
A.前者大
B.后者大
C.二者相等
D.无法判断
| (3)从丙组实验结果分析,HA是________酸(填“强”或“弱”)。该混合溶液中离子浓度由大到小的顺序是___________________________________________。
(4)丁组实验所得混合溶液中由水电离出的c(OH-)=________mol·L-1。
参考答案:(1)=">"(2)C
(3)弱"c(Na+)>c(A-)>c(OH-)>c(H+)
(4)10-5
本题解析:(1)等体积等物质的量浓度的HA与NaOH溶液混合,若HA为强酸,则酸碱恰好中和,pH=7,若HA为弱酸,由于A-的水解则混合后的溶液pH>7。
(3)0.2 mol/L HA和0.1 mol/L的NaOH等体积混合且混合后pH>7,明显HA为弱酸,根据离子守恒可知c(Na+)>c(A-)>c(OH-)>c(H+)
(4)c(OH-)水==10-5
本题难度:一般
2、选择题 下列表述正确的是
A.0.1mol·L-1Na2CO3溶液中:[OH-]=[HCO3-]+[H+]+[H2CO3]
B.0.1mol·L-1CH3COONa溶液中:[Na+]=[CH3COO-]+[OH-]
C.CH3COONa、NaOH和Na2CO3三种溶液的pH相同,则浓度大小顺序:c (NaOH) <c (Na2CO3) <c(CH3COONa)
D.向0.1mol·L-1CH3COOH溶液中滴加NaOH溶液至中性,溶液中离子浓度的关系:[CH3COO-]>[Na+]>[OH-]=[H+]
参考答案:C
本题解析:A.根据质子守恒可得:[OH-]=[HCO3-]+[H+]+2[H2CO3].错误。B.根据物料守恒可得: [Na+]=[CH3COO-]+[CH3COOH].错误。C.NaOH是电离使溶液显碱性,CH3COONa和Na2CO3是盐水解使溶液显碱性,盐的水解程度是很微弱的,所以如果溶液的PH相等,则盐的浓度要大于碱的浓度。酸性:CH3COOH>H2CO3。根据盐的水解规律:谁弱谁水解,越弱越水解,谁强显谁性。所以盐的浓度c (Na2CO3) <c(CH3COONa)。所以弱CH3COONa、NaOH和Na2CO3三种溶液的pH相同,则浓度大小顺序:
c (NaOH) <c (Na2CO3) <c(CH3COONa)。正确。D.根据电荷守恒可得[CH3COO-]+ [OH-]=[Na+]+[H+]。由于溶液呈中性,所以[OH-]=[H+],两式相减可得[CH3COO-] =[Na+]。CH3COO-、Na+是强电解质盐电离产生的,H+、OH-是弱电解质水电离产生的。盐的电离远远大于水的电离,所以[CH3COO-]=[Na+]>[OH-]=[H+]。错误。
本题难度:一般
3、选择题 下列说法正确的是
A.明矾用于净水与Al3+的水解有关
B.配制FeCl3溶液时,为了抑制Fe3+的水解,常加入少量稀硫酸
C.船舶外壳镶嵌锌块以防船体被腐蚀
D.与铜质水龙头连接处的钢质水管不易发生腐蚀
参考答案:AC
本题解析:明矾净水的原理是Al3+水解生成氢氧化铝胶体,吸附水中的悬浮物,A正确;为抑制氯化铁水解,常加入少量盐酸,B错误;船舶外壳镶嵌锌块,形成原电池时,锌作负极被氧化,铁作正极被保护,C正确;铁与铜形成原电池时,铁作负极,被腐蚀,D错误。
点评:保护金属不被腐蚀可形成原电池,使被保护的金属作正极;也可形成电解池,使被保护的金属与直流电源负极相连。
本题难度:一般
4、选择题
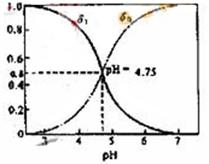
分配系数是指弱电解质溶液中,溶质某种型体浓度与溶质型体总浓度的比值。分配曲线是指弱电解质溶液平衡状态时,每种型体浓度的分配系数与PH之间的关系曲线。对于CH3COOH总浓度c,它只有两种型体,平衡浓度分别为c(CH3COOH)、c(CH3COO-),则c= c(CH3COOH)+c(CH3COO-),设CH3COOH所占分配系数为δ1,CH3COO-所占分配系数为δ0,它们与PH的关系如图所示。下列有关说法正确的是(? )
A.由曲线可知在PH为1~7时,一定有δ1+δ0=1
B.c mol/L 的CH3COOH溶液与c mol/LCH3COONa溶液等体积混合溶液显碱性 的CH3COOH溶液与c mol/LCH3COONa溶液等体积混合溶液显碱性
C.向CH3COOH溶 液中不断滴加氢氧化钠溶液,若c(CH3COO-) >c(Na+) >c(H+)> c(OH-)则δ1一定大于δ0 液中不断滴加氢氧化钠溶液,若c(CH3COO-) >c(Na+) >c(H+)> c(OH-)则δ1一定大于δ0
D.在 cmol/L的H2C2O4(草酸)溶液中,一定满足c(H2C2O4)+ c(C2O42-)=c cmol/L的H2C2O4(草酸)溶液中,一定满足c(H2C2O4)+ c(C2O42-)=c
参考答案:A
本题解析::A项可直接依图判断是正确的;CH3COOH与CH3COONa等量混合后,应考虑以CH3COOH的电离为主,溶液显酸性,故B项错误;C项由离子关系可知,溶液显酸性,结合图示分析,在pH<7时,可能有δ1>δ0,δ1=δ0,δ1<δ0三种情况,故C也错;H2C2O4是一种弱酸,溶液中有三种型体浓度c(H2C2O4)、 c(HC2O4-)和c(C2O42-),故D也错。
本题难度:简单
5、选择题 对滴有酚酞试液的下列溶液,操作后红色变深的是( )
A.AlCl3溶液中在融入AlCl3
B.CH3COONa溶液加热
C.氨水中假如少量NH4Cl固体
D.醋酸溶液加热
参考答案:A.AlCl3在水中电离后产生的Al3+水解使溶液呈酸性,加热导致水解程度增大,但酚酞遇酸性溶液颜色不变化,故A错误;
B.CH3COONa为强碱弱酸盐,水解呈碱性,滴加酚酞后溶液显红色,加热使碱性增强,因此红色变深,故B正确;
C.氨水为弱碱,部分电离:NH3?H2O?NH4++OH-,加入酚酞后溶液变为红色,而NH4Cl=NH4++Cl-,其中的NH4+会抑制氨水的电离,使溶液碱性减弱,颜色变浅,故C错误;
D.醋酸溶液呈酸性,加入酚酞溶液不变色,故D错误.
故选B.
本题解析:
本题难度:简单
|