微信搜索关注"91考试网"公众号,领30元,获取公务员、事业编、教师等考试资料40G!
1、简答题 现有①BaCl2、②金刚石、③NH4Cl、④Na2SO4、⑤干冰、⑥碘片六种物质,按下列要求回答:
(1)熔化时不需要破坏化学键的是______,熔化时需要破坏共价键的是______,
(2)属于离子化合物的是______,只有离子键的物质是______,
(3)①的电子式是______,⑤的电子式是______.
参考答案:①BaCl2属离子晶体,只含离子键;
②金刚石属原子晶体,只含共价键;
③NH4Cl属离子晶体,含离子键、共价键、配位键;
④Na2SO4属离子晶体,含离子键、共价键;
⑤干冰属分子晶体,只含共价键;
⑥碘片属分子晶体,只含共价键;
(1)熔化时不需要破坏化学键的是分子晶体,熔化时需要破坏共价键的是原子晶体.
故答案为:⑤⑥; ②.
(2)根据以上分析,知属于离子化合物的是①③④;只有离子键的物质是①,故答案为:①③④;? ①
(3)氯化钡是离子化合物,书写电子式时要符合离子化合物的特点,干冰的成分是二氧化碳,是共价化合物,书写电子式时要符合共价化合物的特点,故答案为:
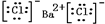
、
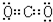
本题解析:
本题难度:一般
2、选择题 下列分子中,没有非极性键的化合物的是(?)
A.H2
B.CO2
C.H2O2
D.C2H4
参考答案:B
本题解析:略
本题难度:简单
3、选择题 若某原子X的原子序数为?26,则下列叙述不正确的是( )
A.X是金属元素
B.X在周期表中位于第四周期
C.X在周期表中位于第ⅧB族
D.X没有负化合价
参考答案:A.X为Fe元素,则属于金属元素,故A正确;
B.18号元素Ar在第三周期的最后方,则26号X在周期表中位于第四周期,故B正确;
C.X位于元素周期表中的第四周期ⅤⅢ族,故C错误;
D.金属只有正价,没有负价,故D正确;
故选C.
本题解析:
本题难度:简单
4、选择题 下列物质的分子中既有σ键,又有π键的是
[? ]
①HCl②H2O③N2④H2O2⑤C2H4⑥C2H2
A.①②③
B.③④⑤⑥
C.①③⑥
D.③⑤⑥
参考答案:D
本题解析:
本题难度:简单
5、简答题 如图为元素周期表中的一部分,A、B、C、D、E均为短周期主族元素,B元素原子的最外层有4个电子,E原子最外层电子数与C的原子序数相等.回答下列问题:
(1)B、D形成的化合物甲,C、D形成的化合物乙,二者晶体结构均为空间网状结构,则其晶体类型为______;乙的化学式为______.
(2)B、D分别可与E形成化合物丙、丁,丙属于______?(填“非极性”或“极性”)分子,试将甲、乙、丙、丁四种物质按熔点由高到低的顺序排列:______.(用化学式表示)
(3)B和C元素形成的物质(BC)2可称为拟卤素,写出该物质与NaOH溶液反应的离子方程式______.
(4)C、E形成的分子的空间构型为三角锥形,分子中各原子最外层均达8电子稳定结构,该物质在潮湿的空气中与水蒸气能发生氧化还原反应,生成含C的无色氧化物气体、C的最高价含氧酸及E的氢化物,写出该反应的化学方程式______.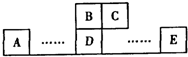
参考答案:A、B、C、D、E均为短周期主族元素,由各元素的相对位置可知,B、C处于第二周期,A、D、E处于第三周期,B元素原子的最外层有4个电子,则B为碳元素,故C为氮元素;B、D同主族,故D为硅元素;E原子最外层电子数与C的原子序数相等,则E最外层电子数为7,故E为氯元素.
故B为碳元素,C为氮元素,D为硅元素,E为氯元素.
(1)B为碳元素、C为氮元素、D为硅元素,B、D形成的化合物甲为SiC,C、D形成的化合物乙,二者晶体结构均为空间网状结构,则其晶体类型为原子晶体;乙的化学式为Si3N4.
故答案为:原子晶体;Si3N4.
(2)B为碳元素、D为硅元素、E为氯元素.B、D分别与E形成化合物丙为CCl4、丁为SiCl4,CCl4是正四面体结构,反应非极性分子;甲(SiC)、乙(Si3N4)是原子晶体,键长C-Si键比N-Si键长,N-Si键更稳定,所以沸点乙>甲,丙(CCl4)、丁(SiCl4)都是分子晶体,结构相似,相对分子质量越大,分子间作用力越强,沸点越高,沸点丁>丙,原子晶体沸点高于分子晶体,所以沸点Si3N4>SiC>SiCl4>CCl4.
故答案为:非极性;Si3N4>SiC>SiCl4>CCl4.
(3)B为碳元素、C为氮元素,B和C元素形成的物质(CN)2为拟卤素,性质与氯气类似,(CN)2与NaOH溶液反应的离子方程式为(CN)2+2OH-=CN-+CNO-+H2O.
故答案为:(CN)2+2OH-=CN-+CNO-+H2O.
(4)C为氮元素、E为氯元素,二者形成的分子的空间构型为三角锥形,分子中各原子最外层均达8电子稳定结构,该物质为NCl3,NCl3在潮湿的空气中与水蒸气能发生氧化还原反应,生成含C的无色氧化物气体为NO、C的最高价含氧酸为HNO3,E的氢化物为HCl,该反应的化学方程式为3NCl3+5H2O=2NO+HNO3+9HCl.
故答案为:3NCl3+5H2O=2NO+HNO3+9HCl.
本题解析:
本题难度:一般