|
高中化学知识点讲解《键参数——键能、键长与键角》考点预测(2017年强化版)(八)
2017-07-27 08:58:05
来源:91考试网
作者:www.91exam.org 【 大 中 小】
参考答案:(1)①sp杂化(2分) 3 NA或3×6.02×1023个?(2分)?
②NH3分子间存在氢键(2分)?③N2O(2分)
(2)①3s23p63d5 ?(1分)?② 5(1分)?分子晶体?(1分)?
(3)立方体(1分)? ?(1分)? ?(1分)?
(4)BC (2分)(漏选得1分,多选、错选不得分)
本题解析:(1)X是元素周期表原子半径最小的元素,则X是H元素;Y原子基态时最外层电子数是其内层电子数的2倍,则Y是C元素;Z原子基态时2p原子轨道上有3个未成对的电子,则Z是N元素;W是Cu元素。①C2H2分子中C原子周围有2个σ键,所以C原子是sp杂化;1molC2H2含有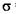 键的数目为3 NA或3×6.02×1023个; 键的数目为3 NA或3×6.02×1023个;
②氨气分子间存在氢键,使分子间作用力增大,沸点升高;
③C的氧化物有CO和CO2,CO与N2是等电子体,CO2与N2O是等电子体;
(2)①基态Fe3+的M层有13个电子,电子排布式为3s23p63d5 ;
②配合物Fe(CO)x的中心原子是铁原子,其价电子数是8,每个配体提供的电子数是2,8+2x=18,x=5,分子晶体的熔沸点较低,根据题给信息知,该物质的熔沸点较低,所以为分子晶体;
(3)O和Na形成的一种只含有离子键的离子化合物为Na2O,该晶胞结构中黑球有8×1/8+6×1/6=4,白球在内部,共有8个,所以黑球为O2-,以晶胞中上面心O2-离子为研究对象,距一个O2-周围最近的Na+离子有8个,位于晶胞中上层4个Na+及上面晶胞中的下层4个Na+,8个Na+离子构成的几何体中每个都是正方形,形成立方体结构;该晶胞质量是4×62/NAg,晶胞密度ρ=4×62/NA/a3,所以a=
(4)A、P的最外层3p轨道是半充满状态,是稳定状态,所以第一电离能最大,错误;B、根据元素周期律判断电负性顺序:C<N<O<F,正确;C、晶格能越大,形成的离子晶体越稳定,晶体的熔点越高,正确;D、二氧化硫分子中硫原子的价层电子对是3且含有一对孤电子对,所以二氧化硫是V形结构,为极性分子,二氧化碳是非极性分子,根据相似相容原理,二氧化硫的溶解度大,错误;E、分子晶体中,共价键键能越大,该分子越稳定,而分子晶体的熔点与分子间作用力有关,错误,答案选BC。
本题难度:一般
2、填空题 氮、磷、砷是同族元素,该族元素单质及其化合物在农药、化肥生产等方面有重要应用。请回答下列问题:
(1)砷原子的核外电子排布式为_____________________________________。
(2)K3[Fe(CN)6]晶体中Fe3+与CN-之间的键型为________,该化学键能够形成的原因是______________________________________________________。
(3)NH4+中氮原子的杂化类型为________,NH4+的空间构型为________。
(4)已知:
?
| CH4
| SiH4
| NH3
| PH3
| 沸点(K)
| 101.7
| 161.2
| 239.7
| 185.4
| 分解温度(K)
| 873
| 773
| 1 073
| 713.2
|
?
分析上表中四种物质的相关数据,请回答:
CH4和SiH4比较,NH3和PH3比较,沸点高低的原因是___________________________________________________________________________。
CH4和SiH4比较,NH3和PH3比较,分解温度高低的原因是_________________________________________________________________________。
结合上述数据和规律判断,一定压强下HF和HCl的混合气体降温时________先液化。
(5)电负性(用X表示)也是元素的一种重要性质,下表给出8种元素的电负性数值:
元素
| Na
| Mg
| Al
| Si
| P
| S
| Cl
| K
| 电负性
| 0.9
| 1.2
| 1.5
| 1.8
| 2.1
| 2.5
| 3.0
| 0.8
|
?
请回答下列有关问题:
估计钙元素的电负性的取值范围:________<X<________。经验规律告诉我们:当形成化学键的两原子相应元素的电负性差值大于1.7时,所形成的一般为离子键;当小于1.7时,一般为共价键。试推断AlCl3中形成的化学键的类型及其理由:__________________________。
参考答案:(1)1s22s22p63s23p63d104s24p3
(2)配位键 CN-能提供孤对电子,Fe3+能接受孤对电子(或Fe3+有空轨道)
(3)sp3 正四面体形
(4)①组成和结构相似时,相对分子质量越大,分子间作用力越大,因此SiH4沸点高于CH4;NH3分子间还存在氢键作用,因此NH3的沸点高于PH3
②C—H键键能大于Si—H键,因此CH4的分解温度高于SiH4的;N—H键键能大于P—H键,因此NH3的分解温度高于PH3的 HF
(5)①0.8 1.2 ②共价键;因为Cl与Al的电负性差值为1.5,小于1.7
本题解析:(1)砷为33号元素,位于第四周期ⅤA族,则可写出其原子核外电子排布式。(2)K3[Fe(CN)6]为配位化合物,其中Fe3+与CN-之间的化学键为配位键,Fe3+有空轨道,而CN-有孤对电子,所以二者可以形成配位键。(3)NH4+中的N原子是中心原子,杂化方式是sp3;NH4+的结构类似于CH4,为正四面体结构。(4)NH3分子间存在氢键,故其沸点比相对分子质量大的PH3高。(5)钙与钾同周期,故其电负性比钾大,与镁同主族,故其电负性比镁小;Al与Cl的电负性差为1.5<1.7,所以AlCl3中的化学键为共价键。
本题难度:一般
3、选择题 在化学上,常用短线表示化学键。在如图所示的结构中,直线不表示化学键或不完全表示化学键的是?
[? ]
A.石墨 ? ?
B.白磷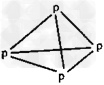 ? ?
C.CCl4?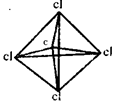 ? ?
D.C8H8(立方烷)
参考答案:AC
本题解析:
本题难度:简单
4、选择题 CO.BF3.CCl4.CH4都是非极性分子,而NH3.H2S.H2O都是极性分子。由此推出ABn型分子是非极性分子的经验规律正确的是
[? ]
A.所有原子在同一平面内
B.分子中不含氢原子
C.A的原子量小于B
D.在ABn分子中A原子化合价的绝对值等于其最外层电子数
参考答案:D
本题解析:
本题难度:一般
5、填空题 A、B、C、D、E、F为原子序数依次增大的短周期主族元素。A、F原子的最外层电子数均等于其周期序数,F原子的电子层数是A的3倍;B原子核外电子分处3个不同能级,且每个能级上排布的电子数相同;A与C形成的最简单分子为三角锥形;D原子p轨道上成对电子数等于未成对电子数;E原子核外每个原子轨道上的电子都已成对,E电负性小于F。
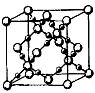
(1)写出B的基态原子的核外电子排布式______________。
(2)A、C形成的最简单分子极易溶于水,其主要原因是______________;与该最简单分子互为等电子体的阳离子为______________。
(3)比较E、F的第一电离能:E________F(选填“>”或“<”)。
(4) BD,在高温高压下所形成的晶胞如上图所示。该晶体的类型属于__________(选填“分子”、“原子”、“离子”或“金属”)晶体,该晶体中B原子的杂化形式为___________。
(5)光谱证实单质F与强碱性溶液反应有[F(OH)4]-生成,则[F(OH)4]-中存在______________。
a.极性键 b.非极性键 c.配位键 d.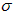 键 e.π键 键 e.π键
参考答案:(1)1s22s22p2
(2)NH3与水分子之间形成氢键;H3O+
(3)>
(4)原子;sp3
(5)acd
本题解析:
本题难度:一般
|