微信搜索关注"91考试网"公众号,领30元,获取公务员、事业编、教师等考试资料40G!
1、选择题 下列颜色变化不是因化学反应引起的是
A.湿润的淀粉KI试纸遇氯气变蓝
B.鸡皮遇浓HNO3呈黄色
C.蔗糖遇浓H2SO4变黑
D.在普通玻璃导管口点燃纯净的H2时,火焰呈黄色
参考答案:D
本题解析:D是钠离子的焰色反应所致,是物理变化.
本题难度:一般
2、选择题 下列实验操作中错误的是
A.蒸发操作时,当大部分固体析出时就停止加热,利用余热把剩下的水蒸干
B.蒸馏操作时,应使温度计水银球靠近蒸馏烧瓶的支管口处
C.分液操作时,分液漏斗中下层液体从下口放出,上层液体从上口倒出
D.萃取操作时,应选择有机萃取剂,且萃取剂的密度必须比水大
参考答案:D
本题解析:分析:A.根据蒸发操作的步骤进行分析;
B.根据蒸馏的原理来确定温度计水银球的位置;
C.上层液体从下口放出,液体会被污染;
D.萃取是根据溶质在不同溶剂中的溶解度不同进行分离;
解答:A.在蒸发溶液出现较多固体时,停止加热,理由蒸发皿的余热蒸干,从而防止发生迸溅、受热分解,故A正确;
B.蒸馏的原理:通过控制沸点的不同来实现物质的分离,所以温度计水银球要靠近蒸馏烧瓶支管口,故B正确;
C.为防止液体污染,分液时,分液漏斗中下层液体从下口放出,上层液体从上口倒出,故C正确;
D.萃取:利用溶质在互不相溶的溶剂里的溶解度的不同,用一种溶剂把溶质从它与另一种溶剂组成的溶液里提取出来.萃取剂必须具备:两种溶剂互不相溶;溶质在萃取剂中的溶解度大于在原溶剂中的溶解度;溶质与萃取剂不反应,萃取剂的密度无须比水大,如用密度比水小的苯可萃取碘水中的碘,故D错误;
故选D.
点评:本题考查化学实验基本操作,注意基础实验方法的积累,题目难度不大.
本题难度:困难
3、填空题 (8分)某课题组研究以硫铁矿(主要成分为FeS2)为原料制备氯化铁晶体(FeCl3·6H2O)的工艺,其设计的流程如下:
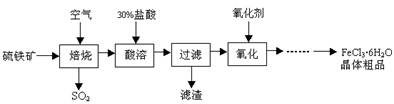
回答下列问题:
(1)已知在焙烧硫铁矿石过程中铁元素转化成了Fe3O4,则该反应的化学方程式是 ;
(2)“酸溶”中反应的离子方程式是 ;
(3)“过滤”后滤液中金属阳离子有 ;
(4)“氧化”中使用的氧化剂最好是 ;
参考答案:(8分,每空2分)(1)3FeS2+8O2 Fe3O4+6SO2;(没配平扣1分,无高温不扣分。)
Fe3O4+6SO2;(没配平扣1分,无高温不扣分。)
(2)Fe3O4+8H+=2Fe3++Fe2++4H2O;(没配平扣1分)
(3)Fe3+、Fe2+(填对1个而未有他错计1分); (4)Cl2(H2O2等只要合理也可);
本题解析:(1)根据流程图可知,FeS2与氧气高温反应生成四氧化三铁和二氧化硫,化学方程式是3FeS2+8O2 Fe3O4+6SO2;
Fe3O4+6SO2;
(2)酸溶发生的反应是四氧化三铁和盐酸反应生成氯化铁、氯化亚铁和水,离子方程式是Fe3O4+8H+=2Fe3++Fe2++4H2O;
(3)根据(2)可知过滤后滤液中的金属阳离子为Fe3+、Fe2+;
(4)将亚铁离子氧化为铁离子,最佳的氧化剂是过氧化氢或氯气,因为过氧化氢会被还原为水,氯气被还原为氯离子,不会产生杂质。
考点:考查化学方程式的书写,对流程的分析
本题难度:一般
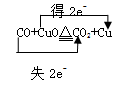
4、计算题 (4*2分)(1)写出 CO与氧化铜反应的化学方程式并标明电子转移的方向和数目。
(2)2.8gCO的物质的量为 mol,含有 个原子,完全与氧化铜反应时失去电子 mol。
参考答案:见解析。
本题解析:
(1)
(2)n(CO)=2.8g/28g·mol-1=0.1mol
N(原子)=0.2mol×6.02×1023/mol=1.204×1023
n(e-)=0.1mol×2=0.2mol
考点:了解氧化还原反应的本质是电子的转移。了解常见的氧化还原反应,能对氧化还原反应配平及相关的简单计算。
点评:本题考查氧化还原反应反应中氧化剂与还原剂的判断及简单计算,属于基础题。
本题难度:一般
5、选择题 已知KClO3与浓HCI反应的化学方程式为:KClO3+6HCl=KCl+3C12+3H2O,若用K35C1O3与H37Cl作用,则下列说法正确的是 ( )
A.所得氯气的相对分子质量约为71
B.KCl中只含35C1
C.所得的KCl中既含35C1又含37Cl
D.被氧化和被还原的氯原子数之比为5∶1