微信搜索关注"91考试网"公众号,领30元,获取公务员、事业编、教师等考试资料40G!
1、选择题 下列离子方程式中,错误的是
A.钠与水反应:Na+H2O=Na++OH-+H2↑
B.盐酸与氢氧化钾溶液反应:H++OH-=H2O
C.铁与稀硫酸反应:Fe+2H+=Fe2++H2↑
D.氯化钠溶液与硝酸银溶液反应:Ag++Cl-=AgCl↓
参考答案:A
本题解析:钠与水反应:Na+H2O=Na++OH-+H2↑,原子不守恒。答案选A。
点评:离子方程式正误判断要注意:看是否符合客观事实、看是否符合质量守恒、看是否符合电荷守恒、看是否符合得失电子相等。可溶的易电离的物质拆成离子。注意过量、少量、适量等。
本题难度:一般
2、选择题 下列离子方程式正确的是( )
A.氯化亚铁溶液中通入少量氯气Fe2++Cl2=Fe3++2Cl-
B.向溴化亚铁溶液中通入过量氯气:Fe2++2Br-+2Cl2═Fe3++Br2+4Cl-
C.向碳酸氢铵溶液中加入足量的NaOH溶液:NH4++OH-=NH3?H2O
D.等体积等物质的量浓度的NaHCO3溶液与Ba(OH)2溶液混合时发生反应:HCO3-+Ba2++OH-═BaCO3↓+H2O
参考答案:A.氯化亚铁溶液中通入少量氯气的离子反应为2Fe2++Cl2=2Fe3++2Cl-,故A错误;
B.向溴化亚铁溶液中通入过量氯气的离子反应为2Fe2++4Br-+3Cl2═2Fe3++2Br2+6Cl-,故B错误;
C.向碳酸氢铵溶液中加入足量的NaOH溶液的离子反应为HCO3-+NH4++2OH-=NH3?H2O+CO32-,故C错误;
D.等体积等物质的量浓度的NaHCO3溶液与Ba(OH)2溶液混合时发生反应的离子反应为
HCO3-+Ba2++OH-═BaCO3↓+H2O,故D正确;
故选D.
本题解析:
本题难度:一般
3、选择题 下列离子方程式中正确的是
[? ]
A.氨水与硫酸溶液的反应:H++OH-=H2O
B.铜与氯化铁溶液反应:Fe3++Cu=Fe2++Cu2+
C.二氧化锰与浓盐酸的反应:MnO2+4H++4Cl-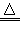 Mn2++Cl2↑+2H2O
Mn2++Cl2↑+2H2O
D.碳酸氢钠与氢氧化钠溶液的反应:HCO3-+OH-=CO32-+H2O
参考答案:D
本题解析:
本题难度:一般
4、选择题 将a L(标准状况)CO2通入100mL 3mol·L-1 NaOH溶液中,下列各项为通入CO2过程中溶液内发生反应的离子方程式,其中不正确的是?
A.a =3.36时,CO2 + 2OH- = CO32- + H2O
B.a =4.48时,2CO2 + 3OH- = CO32- + HCO3- + H2O
C.a =6.72时,CO2 + OH- = HCO3-
D.a =8.96时,3CO2 + 4OH- = CO32- + 2HCO3- + H2O
参考答案:D
本题解析:A、a=3.36时物质的量为:n(CO2)=0.15mol,n(NaOH)=0.3mol;n(CO2):n(NaOH)=0.15mol:0.3mol=1:2,反应离子方程式为:CO2+2OH-=CO32-+H2O;故A正确;
B、a=4.48时,物质的量为:n(CO2)=0.2mol,n(NaOH)=0.3mol;n(CO2):n(NaOH)=0.2mol:0.3mol=2:3,氢氧化钠和二氧化碳恰好反应生成碳酸钠和碳酸氢钠,反应离子方程式可以直平法写出为:2CO2+3OH-=CO32-+HCO3-+H2O,故B正确;
C、a=6.72时物质的量为:n(CO2)=0.3mol,n(NaOH)=0.3mol;n(CO2):n(NaOH)=0.3mol:0.3mol=1:1,反应离子方程式为:CO2+OH-=HCO3-;故C正确;
D、a=8.96时物质的量为:,n(CO2)=0.4mol,n(NaOH)=0.3mol;n(CO2):n(NaOH)=0.4mol:0.3mol=4:3,n(CO2):n(NaOH)>1:1,反应离子方程式为::CO2+OH-=HCO3-;故D错误。
故选D。
点评:本题考查了定量计算的离子方程式的书写方法和产物判断,主要是量不同产物不同的产物判断是解题关键。
本题难度:一般
5、选择题 下表中评价合理的是(?)
选项
| 化学反应及其离子方程式
| 评价
|
A
| FeO与足量的稀硝酸反应:
FeO+2H+=Fe2++H2O
| 正确
|
B
| 向硫酸铵溶液中加入氢氧化钡溶液:
Ba2++ SO42-=BaSO4↓
| 正确
|
C
| 碳酸氢钠溶液中滴加少量的石灰水:
2HCO3-+Ca2++ 2OH-=
CO32- +CaCO3↓+2H2O
| 错误,HCO3-、OH-和H2O的系数应均为1,生成物中没有CO32-?
|
D
| 用食醋除去水瓶中的水垢:
CaCO3+2H+=" " Ca2++H2O+CO2↑
| 错误,醋酸是弱酸,不应写成H+形式
参考答案:D
本题解析:A:硝酸为强氧化性酸,Fe2+会被继续氧化,正确的为:FeO+10H++NO3—=Fe2++NO↑+5H2O;B:除Ba2++ SO42-=BaSO4↓外,还同时存在NH4++OH-=NH3·H2O;C:由于石灰水为少量,所以参加反应的Ca2+与 2OH-的物质的量之比就应该为1:2,原离子方程式完全正确;D:评价完全正确,正确的离子方程式为:CaCO3+2CH3COOH= Ca2++2CH3COO—+H2O+CO2↑
本题难度:一般
|