微信搜索关注"91考试网"公众号,领30元,获取公务员、事业编、教师等考试资料40G!
1、选择题 下列排列顺序不正确的是
A.微粒半径 Na+>K+>Cl->S2-
B.稳定性 HI>HBr>HCl>HF
C.酸性 HClO4>H2SO4>H3PO4>H2SiO3
D.碱性 KOH>Ca(OH)2>Mg(OH)2>Al(OH)3
参考答案:AB
本题解析:A项,应为r(Na+)<r(K+)<r(Cl-)<r(S2-),B项稳定性顺序应为:HI<HBr<HCl<HF。
本题难度:一般
2、选择题 铊是超导材料的组成元素之一,铊在周期表中位于第六周期,与铝是同族元素,元素符号是Tl,以下对铊的性质的推断不正确的是
A.铊是易导电的银白色金属
B.能生成+3价离子化合物
C.Tl(OH)3是两性氢氧化物
D.Tl3+的氧化能力比Al3+强
参考答案:CD
本题解析:试题分析:同主族自上而下金属性逐渐增强,所以选项A正确;第ⅢA族元素的化合价是+3价,B正确;Ti的金属性强于Al的金属性,所以Tl(OH)3不是两性氢氧化物,Tl3+的氧化能力比Al3+弱,CD不正确,答案选CD。
考点:考查元素周期律应用的有关判断
点评:该题基础性强,侧重对学生基础知识的巩固和训练,主要是考查学生灵活运用元素周期律知识解决实际问题的能力,有利于培养学生的逻辑推理能力和发散思维能力。该题的关键是明确元素周期律的含义,然后结合题意灵活运用即可。
本题难度:一般
3、选择题 A、B、C、D、E是核电荷数依次增大的短周期元素,原子半径按D、E、B、C、A的顺序减小,B和E同主族,下列推断不正确的是
A.A、B、E一定在不同周期
B.D为第二周期
C.A、D可能在同一主族
D.C和D的单质可能化合为离子化合物
参考答案:B
本题解析:综合题目所给信息,五种元素在周期表中的相对位置可能为:
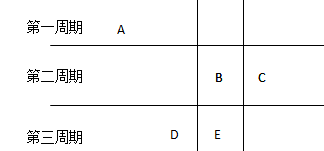
答案为B
本题难度:简单
4、选择题 如图是CaF2晶胞的结构。下列说法正确的是
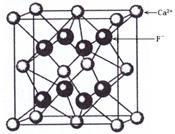
A.一个CaF2晶胞中含有8个Ca2+
B.一个CaF2晶胞中含有8个F-
C.在CaF2晶胞中Ca2+的配位数为4
D.在CaF2晶胞中F-的配位数为8
参考答案:B
本题解析:根据晶胞结构可知,一个CaF2晶胞中含有的Ca2+和F-的个数分别为8×1/8+6×1/2=4,8×1=8,所以A不正确,B正确。配位数是指一个离子周围最邻近的异电性离子的数目。所以根据晶胞的结构可判断Ca2+的配位数是8,F-的配位数是4,即选项CD都是错误的。答案选B。
本题难度:简单
5、选择题 下列基态原子中第一电离能排列顺序正确的是
A.C>N>O>F
B.F>O>N>C
C.I>Br>Cl>F
D.F>Cl>Br>I
参考答案:D
本题解析:基态原子的第一电离能与原子最外层电子所处状态有关,电离能的大小,主要取决于原子的有效核电荷数、原子半径以及原子的价电子构型,一般来说,如果电子层数相同(即处于同一周期)的元素,有效核电荷数越多,原子半径越小,原子核对外层电子的引力越大,因而不易失去电子,电离能就越大;若电子层数不同,而最外层电子数相同(即同一族)的元素,则原子半径越大,原子核对电子的引力越小,就越容易失去电子,电离能也就越小,电子层结构对电离能也有很大影响,稀有气体元素的第一电离能最大,其部分原因就是由于它们具有8个电子稳定结构的缘故,当元素的价电子构型为全空、半满或全满时,其电离能变化规律也会有反常情况(如镁的第一电离能反而大于铝),根据以上原理,在周期表中,元素的第一电离能的总的变化规律应为:同主族元素从上到下,元素的第一电离能逐渐减小,而同一周期元素从左到右,元素的第一电离能逐渐增大。对于相邻两元素电离能大小的判断除考虑上述因素外,还应比较电子层构型有无全满、半满等因素,这样只有D项正确,A和C两项不合上述规律,而B项错误在于N的2p轨道处于半充满结构,因此它的第一电离能反而高于O。
本题难度:困难