微信搜索关注"91考试网"公众号,领30元,获取公务员、事业编、教师等考试资料40G!
1、简答题 已知Cl2在70℃的NaOH水溶液中,能同时发生两个自身氧化还原反应,反应完全后测得溶液中NaClO与NaClO3的物质的量之比为4:1.现有49.7g?Cl2,将其通入到足量70℃的NaOH水溶液中,反应完全后得到500mL溶液.
(1)写出Cl2在70℃的NaOH水溶液中符合上述条件的总反应方程式
(2)计算完全反应后?生成物NaClO3的物质的量浓度.
参考答案:(1)在不同的条件下,氯气和氢氧化钠的反应为:Cl2+2NaOH=NaClO+NaCl+H2O,3Cl2+6NaOH(热)=NaClO3+5NaCl+3H2O,Cl2在70℃的NaOH水溶液中反应是上述两个反应的综合过程,将两个反应相加得:4Cl2+6NaOH=NaClO+NaClO3+6NaCl+4H2O,反应完全后测得溶液中NaClO与NaClO3的物质的量之比为4:1时,对方程式配平后得到:7Cl2+14NaOH=4NaClO+NaClO3+9NaCl+7H2O,故答案为:7Cl2+14NaOH=4NaClO+NaClO3+9NaCl+7H2O;
(2)设生成的氯酸钠的物质的量为n,则
? 7Cl2+14NaOH=4NaClO+NaClO3+9NaCl+7H2O
? 7? 1
49.7g71g/mol?n
即749.7g71g/mol=1n
解得n=0.1mol
所以生成物NaClO3的物质的量浓度=0.1mol0.5L=0.2mol/L
答:生成物NaClO3的物质的量浓度为0.2mol/L.
本题解析:
本题难度:一般
2、选择题 化学用语是学习化学的重要工具,下列表示物质变化的化学用语中,正确的是
A.电解饱和食盐水时,阳极的电极反应式为:2Cl—-2e—==Cl2↑
B.明矾净水时,主要反应的离子方程式为: Al3++3H2O==Al(OH)3 ↓+3H+
C.氢硫酸的电离方程式为:H2S  2H++S2—
2H++S2—
D.钢铁发生电化学腐蚀的正极反应式:Fe-2e—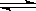 Fe2+
Fe2+
参考答案:A
本题解析:
正确答案:A
A.正确,电解饱和食盐水时,阳极发生氧化反应,电极反应式为:2Cl—-2e—==Cl2↑
B.不正确,明矾净水时,主要反应的离子方程式为: Al3++3H2O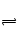 Al(OH)3 +3H+
Al(OH)3 +3H+
C.不正确,氢硫酸的电离方程式为:H2S  H++HS—
H++HS—
D.不正确,钢铁发生电化学腐蚀的正极反应式:O2+4?e-+2H2O=4OH―
本题难度:一般
3、选择题 人们常用图示的方法表示不同反应类型之间的关系。如分解反应和氧化还原反应可用左下图表示。右下图为离子反应、氧化还原反应和置换反应三者之间的关系,则C表示

A.离子反应
B.氧化还原反应
C.置换反应
D.三者都可以
参考答案:A
本题解析:置换反应一定有化合价的升降,一定属于氧化还原反应,故B代表置换反应,而A代表氧化还原反应,进而可知C为离子反应,与前两者均有交叉。故选A
本题难度:简单
4、选择题 设NA代表阿伏加德罗常数,下列叙述正确的是(?)
A.标准状况下2.24 L H2O中,分子数为0.1 NA
B.将1 mol Cl2通入到水中,则N(HClO)+N(Cl-)+N(ClO-)=2NA
C.常温常压下16 g O2和O3混合气体中,氧原子数为NA
D.7.8 g Na2O2与足量水反应,转移电子数为0.2NA
参考答案:C
本题解析:A项,标准状况下,水为液体;B项,Cl2和H2O反应是可逆反应,2N(Cl2)+N(HClO)+N(Cl-)+N(ClO-)=2NA;D项,Na2O2与水反应,Na2O2既是氧化剂,又是还原剂,7.8 g Na2O2与水反应,应转移0.1NA电子。
本题难度:一般
5、选择题 下列有关氧化还原反应的叙述正确的是
A.在一定条件下能发生反应:3O2=2O3,该反应不属于氧化还原反应
B.氧化反应一定先于还原反应发生
C.氧化性强的物质与还原性强的物质接触一定能发生反应
D.氧化剂本身一定只发生还原反应
参考答案:A
本题解析:A、氧化还原反应的特征是元素的化合价发生变化,3O2=2O3的化合价未发生变化,因此不属于氧化还原反应,正确;B、氧化反应与还原反应是同时发生的,没有先后之分,错误;C、氧化性强的物质与还原性强的物质接触不一定发生反应,如Cl2与Na仅接触不点燃是不会反应的,错误;D、氧化剂本身一定会发生还原反应,还可能发生氧化反应或其他反应,错误,答案选A。
本题难度:一般