微信搜索关注"91考试网"公众号,领30元,获取公务员、事业编、教师等考试资料40G!
1、选择题 在含有70克N2,128克O2和44克CO2的混和气体(标准状况)中,氮气所占体积百分比为
A.29.3%
B.33.3%
C.36%
D.50%
参考答案:B
本题解析:70克N2,128克O2和44克CO2的物质的量分别为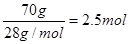 、
、 、
、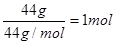 。因为在相同条件下,体积之比就是物质的量之比,所以氮气所占体积百分比为
。因为在相同条件下,体积之比就是物质的量之比,所以氮气所占体积百分比为 ,即选项B正确。
,即选项B正确。
本题难度:一般
2、选择题 燃烧下列混合气体,所产生的CO2的量一定小于燃烧相同质量的丙烯所产生的CO2的量的是( )
A.丁烯、丙烯
B.乙炔、乙烯
C.乙炔、丙烷
D.乙烷、环丙烷(C3H6)
参考答案:D
本题解析:
本题难度:简单
3、简答题 中学化学常见的物质A、B、C、D之间存在如下转化关系:A+B→C+D+H2O(没有配平).请按要求填空:
(1)若A为短周期元素组成的黑色固体单质,与B的浓溶液共热时,产生C、D两种气体.C、D两种气体均能使澄清石灰水变浑浊,则该反应的化学方程式是:______,鉴别这两种气体不能选用的试剂是______
a.BaCl2溶液?b.KMnO4溶液?c.品红溶液? d.酸化的Ba(NO3)2溶液
向500mL2mol/L的NaOH溶液中通入0.8mol无色无味的C气体,恰好完全反应,该反应的化学方程式是______.此时溶液中的离子按照浓度由大到小排列的顺序是______.
(2)若A为红色金属单质,与适量B的溶液在常温下恰好完全反应,生成的无色气体C遇空气迅速变成经棕色.若被还原的B物质的量为2mol时,产生C气体的体积是______?L(标况).将生成的红棕色气体通入一个烧瓶里,塞紧瓶塞后,将烧瓶浸入冰水中,烧瓶中气体的颜色变浅,请用化学方程式和必要的文字解释颜色变化的原因______.
(3)若A在水中的溶解度随温度的升高而降低;B为短周期非金属单质;D是漂白粉的成分之一.C发生水解反应的离子方程式是______
(4)若A为五核10电子的阳离子与单核18电子的阴离子构成的无色晶体,受热易分解,分解后生成两种极易溶于水的气体.检验A中阴离子的方法是______(简述操作过程及结论).
参考答案:(1)C、D两种气体均能使澄清石灰水变浑浊,能使澄清石灰水变浑浊的气体是二氧化碳和二氧化硫,所以C、D和二氧化碳和二氧化硫,A是碳,加热条件下,碳和浓硫酸反应生成二氧化碳、二氧化硫和水,反应方程式为:C+2H2SO4(浓)?△?.??CO2↑+2SO2↑+2H2O;
二氧化碳和二氧化硫相同的性质是都能使澄清石灰水变浑浊,不同点是二氧化硫具有漂白性和还原性,
a、二氧化硫和二氧化碳都不和氯化钡反应,所以现象相同,无法鉴别,故选;
b、二氧化硫能使酸性高锰酸钾褪色,二氧化碳不能使酸性高锰酸钾溶液褪色,所以能鉴别,故不选;
c、二氧化硫能使品红溶液褪色,二氧化碳不能使品红溶液褪色,所以能鉴别,故不选;
d、二氧化硫能和硝酸酸化的硝酸钡反应生成白色沉淀,二氧化碳不能和硝酸酸化的硝酸钡反应,所以能鉴别,故不选;
故选a;
氢氧化钠的物质的量=2mol/L×0.5L=1mol,二氧化碳的物质的量是0.8mol,1<n(NaOH)n(CO2)=54<2,所以氢氧化钠和二氧化碳反应生成碳酸钠和碳酸氢钠,氢氧化钠和二氧化碳恰好反应生成碳酸钠和碳酸氢钠,反应方程式为5NaOH+4CO2═Na2CO3+3NaHCO3+H2O;
5NaOH+4CO2═Na2CO3+3NaHCO3+H2O;
5mol 4mol? 1mol? 3mol
1mol 0.8mol 0.2mol 0.6mol
通过方程式知,生成0.2mol碳酸钠、0.6mol碳酸氢钠,钠离子不水解浓度最大,虽然碳酸钠和碳酸氢钠能水解,但盐在溶液中以电离为主,水解为次,所以碳酸氢根离子浓度大于碳酸根离子浓度,碳酸根离子和碳酸氢根离子水解导致氢氧根离子浓度大于氢离子浓度而使溶液呈碱性,所以离子浓度大小顺序为:c(Na+)>c(HCO3-)>c(CO3 2- )>c(OH-)>c(H+);
故答案为:C+2H2SO4(浓)?△?.??CO2↑+2SO2↑+2H2O,a,5NaOH+4CO2═Na2CO3+3NaHCO3+H2O,c(Na+)>c(HCO3-)>c(CO3 2- )>c(OH-)>c(H+);
(2)无色气体C遇空气迅速变成经棕色,所以C是NO,A为红色金属单质铜,铜和稀硝酸反应生成硝酸铜、一氧化氮和水,所以B是稀硝酸,根据氮原子守恒计算一氧化氮气体体积,设NO体积为X,
HNO3----NO,
1mol? 22.4L
2mol? x
x=44.8L
二氧化氮能自身转化为四氧化二氮,且二氧化氮和四氧化二氮之间存在化学平衡,该反应是放热反应,降低温度平衡向正反应方向移动,气体颜色变浅;
故答案为:44.8,2NO2(红棕色)?N2O4(无色);△H<0,降温,平衡向正反应方向移动,红棕色NO2浓度减小,混合气体的颜色变浅;
(3)若A在水中的溶解度随温度的升高而降低是氢氧化钙,B为短周期非金属单质,D是漂白粉的成分之一,氢氧化钙和氯气反应生成氯化钙、次氯酸钙和水,所以B是氯气,C能发生水解反应,所以C是次氯酸钙,D是氯化钙,次氯酸根离子水解方程式为:ClO-+H2O?HClO+OH-;
故答案为:ClO-+H2O?HClO+OH-;
(4)若A为五核10电子的阳离子与单核18电子的阴离子构成的无色晶体,五核10电子的阳离子是铵根离子,受热易分解,分解后生成两种极易溶于水的气体,则A是氯化铵,单核18电子的阴离子是氯离子,氯离子的检验方法是:取少量A于一洁净试管中,加蒸馏水溶解后,滴加硝酸银溶液,产生白色没淀,再滴加稀硝酸,振荡,沉淀不溶解,则A的阴离子为Cl-.
故答案为:取少量A于一洁净试管中,加蒸馏水溶解后,滴加硝酸银溶液,产生白色没淀,再滴加稀硝酸,振荡,沉淀不溶解,则A的阴离子为Cl-.
本题解析:
本题难度:一般
4、选择题 在浓盐酸中HNO2与SnCl2反应的离子方程式为:3SnCl2+12Cl-+2HNO2+6H+===N2↑+3SnCl+4H2O关于该反应的说法中正确的组合是( )
①氧化剂是HNO2 ?②还原性:Cl->N2
③每生成2.8 g N2,还原剂失去的电子为0.6 mol ?④x为4,y为2 ⑤SnCl是氧化产物
A.①③⑤
B.①②④⑤
C.①②③④
D.只有①③
参考答案:A
本题解析:反应中,HNO2得到电子为氧化剂,SnCl2失去电子为还原剂,其对应产物SnCl是氧化产物。Cl-在反应中没有得失电子。每生成1 mol N2转移6 mol电子,故生成2.8 g N2(0.1 mol),SnCl2失去0.6 mol电子。根据电荷守恒有:-12+6=-3y,y=2,根据原子守恒有:6+12=3x,x=6。综合上述,①③⑤正确,故选A。
点评:本题主要考查氧化还原反应的知识,要求会计算得失电子数以及会判断氧化剂和还原剂、氧化产物和还原产物等。题目较难。
本题难度:简单
5、选择题 某元素在化学反应中由化合态变为游离态,则该元素?(?)
A.一定被氧化了
B.一定被还原了
C.既可能被氧化也可能被还原
D.既不可能被氧化,也不可能被还原
参考答案:C
本题解析:某元素在化学反应中由化合态变为游离态,则该元素的化合价可能升高,也可能降低,即该元素既可能被氧化也可能被还原,答案选C。
点评:该题是基础性试题的考查,试题难易适中,侧重能力的培养。该题的关键是明确元素在化合物中可能显正价,也可能显负价,据此可以判断。有利于培养学生的逻辑思维能力和灵活应变能力。
本题难度:简单