微信搜索关注"91考试网"公众号,领30元,获取公务员、事业编、教师等考试资料40G!
1、简答题 HCl气体极易溶于水,若向水中通入标准状况下的44.8LHCl气体配成1L盐酸,所得盐酸的物质的量浓度为______;取此盐酸250mL与小苏打反应,请计算最多可以产生二氧化碳的体积(标准状况).______.
参考答案:n(HCl)=44.8L22.4L/mol=2mol,c=2mol1L=2mol/L,
根据HCl+NaHCO3=NaCl+CO2↑+H2O中氯化氢和二氧化碳的关系式得,生成V(CO2)=2mol/L×0.25L1×1×22.4L/mol=11.2L,
故答案为:2.0mol/L;11.2L.
本题解析:
本题难度:一般
2、选择题 VL Fe2(SO4)3溶液中含有Fe3+mg,则溶液中SO的物质的量浓度为( )
A.mol/L
B.mol/L
C.mol/L
D.mol/L
参考答案:D
本题解析:n(Fe3+)="m/56" mol? n(SO)=" 3m/112" mol? C(SO)= mol/L故先D
本题难度:简单
3、选择题 448 mL 某气体在标准状况下的质量为1.28 g,该气体的摩尔质量约为
A.64 g
B.64
C.64 g/mol
D.32 g/mol
参考答案:C
本题解析:标况下,448ml为0.02mol,M===64g/mol;答案选C。
本题难度:简单
4、选择题 设NA是阿伏加德罗常数的值,下列说法正确的是
A.标准状况下,22.4L乙醇中含有的氧原子数为NA
B.标准状况下,1.12L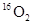 和1.12L
和1.12L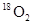 均含有0.1
均含有0.1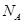 个氧原子
个氧原子
C.在Na2O2与水的反应中,
D.25℃时,pH=13的Ba(OH)2溶液中含有OH-数目为0.2NA
参考答案:B
本题解析:标准状况下,乙醇是液体,A不正确。标准状况下,1.12L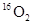 和1.12L
和1.12L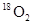 的物质的量均是0.05mol,所以含有的氧原子数是0.1
的物质的量均是0.05mol,所以含有的氧原子数是0.1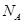 ,与氧原子的质量数无关,B正确。Na2O2与水的反应时过氧化钠既作氧化剂,又作还原剂,方程式为2Na2O2+2H2O=4NaOH+O2↑,所以生成l mol O2转移的电子数为2×6.02×1023,C不正确。D中没有指明溶液的体积,因此无法计算离子的数目。答案选B。
,与氧原子的质量数无关,B正确。Na2O2与水的反应时过氧化钠既作氧化剂,又作还原剂,方程式为2Na2O2+2H2O=4NaOH+O2↑,所以生成l mol O2转移的电子数为2×6.02×1023,C不正确。D中没有指明溶液的体积,因此无法计算离子的数目。答案选B。
本题难度:简单
5、填空题 (10分)(1)实验室里常用浓盐酸与二氧化锰反应来制取少量的氯气,反应的化学方程式为:MnO2+4HCl(浓)  MnCl2+Cl2↑+2H2O,取一定量的浓盐酸使其与二氧化锰发生反应,产生的氯气在标准状况下的体积为22.4 L。
MnCl2+Cl2↑+2H2O,取一定量的浓盐酸使其与二氧化锰发生反应,产生的氯气在标准状况下的体积为22.4 L。
请回答下列问题:
①写出该反应的离子反应方程式_________________________,②反应中被氧化的HCl的物质的量为 ________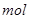 。③实验室备用的浓盐酸质量分数为36.5%,密度为1.19 g·cm-3,为使用方便,请计算出该浓盐酸的物质的量浓度_________
。③实验室备用的浓盐酸质量分数为36.5%,密度为1.19 g·cm-3,为使用方便,请计算出该浓盐酸的物质的量浓度_________ 。
。
(2)把一小块镁铝合金溶于100mL盐酸中,然后向其中滴入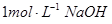 溶液,生成沉淀的质量和加入NaOH溶液的体积如下图所示。
溶液,生成沉淀的质量和加入NaOH溶液的体积如下图所示。

①合金中镁的质量 g。
②盐酸的物质的量浓度  。
。
参考答案:①MnO2+2Cl-+4H+===Mn2++Cl2↑+2H2O
②2 mol③11.9 mol·L-1 (2) 0.12 0.5
本题解析:本题涉及Cl2的实验室制法,难度不大。结合图像的计算也属基础题型,关键结合题给信息,分析图中的数据再根据方程式计算可得。10mLNaOH用于中和盐酸,40mLNaOH用于沉淀Mg2 + 、Al3+;Cl-转化为NaCl,由Na+可确定Cl-的量,即HCl的物质的量,为0.05mol;可求得盐酸的浓度为0.5mol/L;结合图像B C发生反应Al(OH)3+OH-=AlO2-+2H2O,计算消耗NaOH的物质的量为0.01mol,可知用于沉淀Al3+的OH-为0.03mol,则其余用于沉淀Mg2+,由反应Mg2++2OH-=Mg(OH)2↓可求得Mg2+的物质的量为0.005mol,从而金属Mg的质量为0.12g。
C发生反应Al(OH)3+OH-=AlO2-+2H2O,计算消耗NaOH的物质的量为0.01mol,可知用于沉淀Al3+的OH-为0.03mol,则其余用于沉淀Mg2+,由反应Mg2++2OH-=Mg(OH)2↓可求得Mg2+的物质的量为0.005mol,从而金属Mg的质量为0.12g。
考点:化学计算。
本题难度:一般