微信搜索关注"91考试网"公众号,领30元,获取公务员、事业编、教师等考试资料40G!
1、选择题 下列有关图像的分析正确的是?(?)
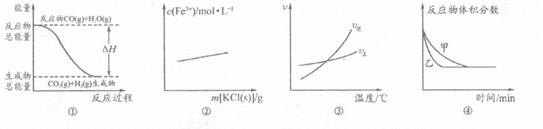
A.图①表示反应“CO(g)+H2O(g) CO2(g)+H2(g)”中的△H大于0
CO2(g)+H2(g)”中的△H大于0
B.图②可表示反应“3KSCN+FeCl3 Fe(SCN)3+3KCl”向正反应方向移动
Fe(SCN)3+3KCl”向正反应方向移动
C.图③表示反应“A2(g)+3Br(g) 2AB3(g)”的△H小于0
2AB3(g)”的△H小于0
D.图④可表示压强对反应“2A(g)+2B(g) 3C(g)+D(s)”的影响,且乙
3C(g)+D(s)”的影响,且乙 的压强大
的压强大
2、填空题 (15分)铁及其化合物与生产、生活关系密切。
(1)下图是实验室研究海水对铁闸不同部位腐蚀情况的剖面示意图。
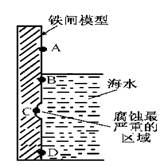
①该电化腐蚀称为?。
②图中A、B、C、D四个区域,生成铁锈最多的是?(填字母)。
(2)用废铁皮制取铁红(Fe2O3)的部分流程示意图如下:
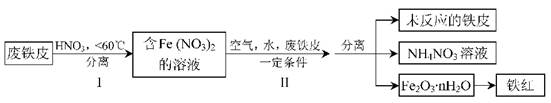
①步骤I若温度过高,将导致硝酸分解。硝酸分解的化学方程式为?。
②步骤Ⅱ中发生反应:4Fe(NO3)2+O2+(2n+4)H2O=2Fe2O3·nH2O+8HNO3,反应产生的HNO3又将废铁皮中的铁转化为Fe(NO3)2,该反应的化学方程式为?。
③上述生产流程中,能体现“绿色化学”思想的是?(任写一项)。
(3)已知t℃时,反应FeO(s)+CO(g) Fe(s)+CO2(g)的平衡常数K=0.25。
Fe(s)+CO2(g)的平衡常数K=0.25。
①t℃时,反应达到平衡时n(CO):n(CO2)=?。
②若在1 L密闭容器中加入0.02 mol FeO(s),并通入xmolCO,t℃时反应达到平衡。此时FeO(s)转化率为50%,则x=?。
3、选择题 可逆反应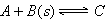 达到平衡后,无论加压或降温。B的转化率都增大,则下列结论正确的是
达到平衡后,无论加压或降温。B的转化率都增大,则下列结论正确的是
[? ]
A.A为气体,C为固体,正反应为放热反应
B.A为固体,C为气体,正反应为放热反应
C.A为气体,C为固体,正反应为吸热反应
D.A、C均为气体,正反应为吸热反应
4、填空题 8分)一定温度下,在容积为1L的密闭容器内放入2mol N2O4和8 mol NO2,发生如下反应:2NO2(红棕色)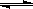 N2O4(无色)(△H<0),反应中NO2、N2O4的物质的量随反应时间变化的曲线如下图,按下列要求作答:
N2O4(无色)(△H<0),反应中NO2、N2O4的物质的量随反应时间变化的曲线如下图,按下列要求作答:
(1)在该温度下,反应的化学平衡常数表达式为:
(2)若t1=10s,t2=20s,计算从t1至t2时以N2O4表示的反应速率: mol·L-1·s-1
(3)图中t1、t2、t3哪一个时刻表示反应已经达到平衡?答:
(4)t1时,正反应速率 (填“>”、“<”或“=”)逆反应速率
(5)维持容器的温度不变,若缩小容器的体积,则平衡向 移动
(填“正反应方向”、“逆反应方向”或“不移动”)
(6)维持容器的体积不变,升高温度,达到新平衡时体系的颜色
(填“变深”、“变浅”或“不变”)
5、选择题 一定温度下,可逆反应:A(s)+2B(g)

2C(g)+D(g)△H<0在甲、乙两容器中进行.起始时,将1mol?A和2molB加入甲容器中,将4molC和2mol?D加入乙容器中,此时控制活塞P,使乙的容积为甲的2倍,t1时两容器内均达到平衡状态(如图1所示,隔板K不能移动).下列说法正确的是( )

A.保持温度和活塞位置不变,在甲中再加入1molA和2molB,达到新的平衡后,甲中C的浓度是乙中C的浓度的2倍
B.保持活塞位置不变,升高两个容器的温度,达到新的平衡后,甲中B的体积分数增大,乙中B的体积分数不变
C.保持温度不变,移动活塞P,使乙的容积和甲相等,达到新的平衡后,乙中C的体积分数是甲中C的体积分数的2倍
D.保持温度和乙中的压强不变,t2时分别向甲、乙中加入等质量的氦气后,甲、乙中反应速率变化情况分别如图2和图3所示(t1前的反应速率变化已省略)