微信搜索关注"91考试网"公众号,领30元,获取公务员、事业编、教师等考试资料40G!
1、填空题 某元素最高正化合价为+6,其最低负价为________。某元素R与氢形成的气态氢化物的化学式为RH3,其最高价氧化物的化学式为____________。
参考答案:-2;R2O5
本题解析:
本题难度:一般
2、选择题 下列说法中正确的是:
A.原子及其离子的核外电子层数等于该元素所在的周期数
B.元素周期表中从IIIB族到IIB族 10个纵行的元素都是金属元素
C.第ⅠA族元素的金属性比第ⅡA族元素的金属性强
D.在周期表里,主族元素所在的族序数等于原子核外电子数
参考答案:B
本题解析:A不正确,例如钠离子核外有2个电子层,但钠是第三周期。C不正确,应该是同周期元素才能满足。D不正确,主族元素所在的族序数等于原子核外最外层电子数,所以答案选B,
本题难度:简单
3、选择题 元素X的原子核外M电子层有3个电子,元素Y2-离子核外共有18个电子,则这两种元素可形成的化合物为
[? ]
A.XY2
B.X2Y
C.X2Y3
D.X3Y2
参考答案:C
本题解析:
本题难度:一般
4、填空题 短周期的五种元素A、B、C、D、E,原子序数依次增大。A、B、C三种元素电子层数之和是5。A、B两元素原子最外层电子数之和等于C元素原子最外层电子数;B元素原子最外电子层上的电子数是它的电子层数的2倍,A与D可以形成原子个数比分别为1∶1和2∶1的两种液态化合物;E单质用于净化水质。
请回答:
(1)写出D在元素周期表中的位置 ?,?
E的原子结构示意图是 。?
下列可以验证C与D两元素原子得电子能力强弱的实验事实是 (填写编号)。?
A.比较这两种元素的气态氢化物的沸点
B.比较只有这两种元素所形成的化合物中的化合价
C.比较这两种元素的气态氢化物的稳定性
D.比较这两种元素的单质与氢气化合的难易
(2)由A、B两种元素组成的最简单的化合物,写出其电子式 。?
(3)均由A、B、C、D四种元素组成的甲、乙两种化合物,都既可以与盐酸反应又可以与NaOH溶液反应,甲为无机盐,其化学式为 ,乙为天然高分子化合物的水解产物,且是同类物质中相对分子质量最小的,其结构简式为 。?
(4)胶态磁流体在医学上有重要的用途,而纳米级Fe3O4是磁流体中的重要粒子,其制备过程可简单表示如下:
①将化合物CA3通入等物质的量的FeSO4、Fe2(SO4)3的混合溶液中,生成两种碱,写出该反应过程的总的离子方程式 ?。?
②上述反应生成的两种碱继续作用,得到Fe3O4。
(5)已知下表数据:
物质
| Fe(OH)2
| Fe(OH)3
|
Ksp/25 ℃
| 2.0×10-16
| 4.0×10-36
|
?
若使混合液中FeSO4、Fe2(SO4)3的浓度均为2.0 mol·L-1,则混合液中c(OH-)不得大于 mol·L-1。?
参考答案:(1)第二周期ⅥA族 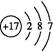 BCD
BCD
(2) 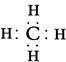
(3)NH4HCO3 或(NH4)2 CO3 H2NCH2COOH
(4)Fe2++2Fe3++8NH3+8H2O Fe(OH)2↓+2Fe(OH)3↓+8NH4+
Fe(OH)2↓+2Fe(OH)3↓+8NH4+
(5)10-12
本题解析:根据A、D可形成的两种液态化合物的情况知,这两种化合物为H2O和H2O2,再结合原子序数增大,所以A为H,D为O,则B只能为C,C为N,E单质可净化水质,E为Cl。
(1)O的原子序数是8,位于第二周期ⅥA族 ;氯元素位于第三周期ⅦA族,所以原子结构示意图为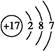 ;由气态氢化物的沸点无法确定元素的非金属性强弱。答案选BCD。
;由气态氢化物的沸点无法确定元素的非金属性强弱。答案选BCD。
(2)由A、B两种元素组成的最简单的化合物是甲烷,电子式为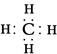 。
。
(3)都既可以与盐酸反应又可以与NaOH溶液反应,一般是弱酸的酸式盐或弱酸的铵盐或氨基酸,因此甲是碳酸氢铵或碳酸铵,乙是甘氨酸。化学式分别是NH4HCO3 或(NH4)2 CO3、H2NCH2COOH。
(4)①根据原子守恒可知,两种碱应该是氢氧化铁和氢氧化亚铁,所以方程式为Fe2++2Fe3++8NH3+8H2O Fe(OH)2↓+2Fe(OH)3↓+8NH4+。
Fe(OH)2↓+2Fe(OH)3↓+8NH4+。
(5)亚铁离子和铁离子的浓度分别是2.0 mol·L-1和4.0 mol·L-1,所以根据溶度积常数可知,相应OH-浓度分别是10-8 mol·L-1、10-12 mol·L-1,所以混合液中c(OH-)不得大于10-12 mol·L-1。
本题难度:一般
5、填空题 A、B、C、D为四种短周期元素,A原子核外仅有1个电子,B、C元素的最高价依次+4、+5,D元素常显-2价,已知B、C、D的原子次外层电子数均为2。
(1)按要求写出:A元素符号____________,B原子结构示意图____________,C单质分子的电子式
____________。
(2)X、Y、Z、W四种化合物均含上述四种元素,且都属于盐,其中X、Y、Z三种化合物分子式中都只含一个B原子,X和Y的阴离子带一个单位电荷,但X的阴离子比Y阴离子少一个D原子;Z和W的阴离子都带两个单位的负电荷,W中含有两个B原子。
①写出Z、W的化学式,Z为____________,W为____________。
②写出Y的溶液与过量NaOH反应的离子方程式________________________。
参考答案:(1)H; ;
;
(2)①(NH4)2CO3;(NH4)2C2O2;②NH4++HCO3-+2OH-==NH3·H2O+2H2O+CO32-
本题解析:
本题难度:一般