微信搜索关注"91考试网"公众号,领30元,获取公务员、事业编、教师等考试资料40G!
1、选择题 1000℃时,FeO(s) + H2 ?Fe(s) + H2O,K=0.52。欲使容器中有1.0 mol FeO被还原,反应前容器中应充入a mol H2。则a最接近
?Fe(s) + H2O,K=0.52。欲使容器中有1.0 mol FeO被还原,反应前容器中应充入a mol H2。则a最接近
A.1.0
B.2.0
C.3.0
D.4.0
参考答案:C
本题解析:根据方程式可知,消耗氢气的物质的量是1mol,生成水蒸气是1mol,剩余氢气是(a-1)mol。由于反应前后体积不变,则可以用物质的量代替浓度表示平衡常数,则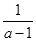 ?=0.52,解得a=2.93,属于答案选C。
?=0.52,解得a=2.93,属于答案选C。
本题难度:一般
2、填空题 (15分)“低碳循环”已引起各国家的高度重视,而如何降低大气中CO2的含量和有效地开发利用CO2正成为化学家研究的主要课题。
(l)用电弧法合成的储氢纳米碳管常伴有大量的碳纳米颗粒(杂质),这种颗粒可用如下氧化法提纯,请完成该反应的化学方程式:
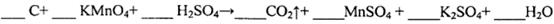
(2)将不同量的CO(g)和H2O(g)分别通入到体积为2L的恒容密闭容器中,进行反应 ,得到如下两组数据:
,得到如下两组数据:
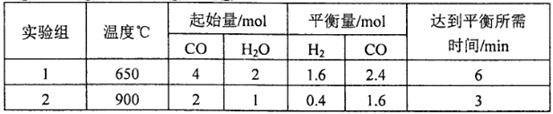
①实验2条件下平衡常数K= __________。
②实验3,若900℃时,在此容器中加入CO、H2O、CO2、H2均为1mol,则此时
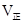 ____________
____________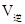 (填“<”,“>”,“=”)。
(填“<”,“>”,“=”)。
③由两组实验结果,可判断该反应的正反应△H_____________0(填“<”,‘‘>”,“=”)。
(3)己知在常温常压下:
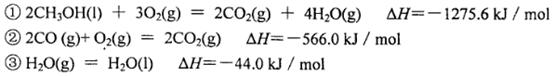
写出甲醇不完全燃烧生成一氧化碳和液态水的热化学方程式:________________________
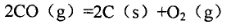
①已知该反应的△H>0,简述该设想能否实现的依据:________。
②目前,在汽车尾气系统中装置催化转化器可减少CO和NO的污染,其化学反应方程式为__________。
(5)CO2在自然界循环时可与CaCO3反应,CaCO3是一种难溶物质,其Ksp=2.8× 10 。CaCl2溶液与Na2CO3溶液混合可形成CaCO3沉淀,现将等体积的CaCl2溶液与Na2CO3溶液混合,若Na2CO3溶液的浓度为1×10
。CaCl2溶液与Na2CO3溶液混合可形成CaCO3沉淀,现将等体积的CaCl2溶液与Na2CO3溶液混合,若Na2CO3溶液的浓度为1×10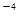 mol/L,则生成沉淀所需CaCl2溶液的最小浓度为__________mol/L。
mol/L,则生成沉淀所需CaCl2溶液的最小浓度为__________mol/L。
参考答案:(1)5、4、6、5、4、2、6;(2)①0.17;②<;③<;
(3)CH3OH(l)+O2(g)=CO(g)+2H2O(l)?H= -442.8KJ/mol;
(4)①该反应是焓增、熵减的反应,任何温度下均不能自发进行;②2CO+2NO 2CO2+N2;
2CO2+N2;
(5)1.12×10-4
本题解析:(l)该反应是氧化还原反应。根据氧化还原反应中电子转移数目与化合价升降总数相等可得该反应的方程式,配平为5C+4KMnO4+6H2SO4=5CO2↑+4MnSO4+2K2SO4+6H2O;(2) ①实验2条件下平衡常数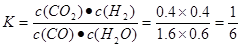 =0.17。②实验3,若900℃时,在此容器中加入CO、H2O、CO2、H2均为1mol,由于生成物的浓度增大的多于反应物增大的浓度,因此在此时
=0.17。②实验3,若900℃时,在此容器中加入CO、H2O、CO2、H2均为1mol,由于生成物的浓度增大的多于反应物增大的浓度,因此在此时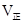 <
<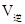 。③在实验1条件下平衡常数
。③在实验1条件下平衡常数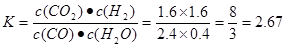 可见升高温度,化学平衡常数减小。说明升高温度,平衡逆向移动。根据平衡移动原理。升高温度,化学平衡向吸热反应方向移动。逆反应方向为吸热反应,实验正反应为放热反应。因此该反应的正反应△H<0。(3) (①-②)÷2+③×2,整理可得CH3OH(l)+O2(g)=CO(g)+2H2O(l)?H= -442.8KJ/mol;①由已知条件可知:该反应是焓增、熵减的反应,所以在任何温度下均不能自发进行;②目前,在汽车尾气系统中装置催化转化器可减少CO和NO的污染,使其转化为无毒的大气的成分。该反应的化学反应方程式为2CO+2NO
可见升高温度,化学平衡常数减小。说明升高温度,平衡逆向移动。根据平衡移动原理。升高温度,化学平衡向吸热反应方向移动。逆反应方向为吸热反应,实验正反应为放热反应。因此该反应的正反应△H<0。(3) (①-②)÷2+③×2,整理可得CH3OH(l)+O2(g)=CO(g)+2H2O(l)?H= -442.8KJ/mol;①由已知条件可知:该反应是焓增、熵减的反应,所以在任何温度下均不能自发进行;②目前,在汽车尾气系统中装置催化转化器可减少CO和NO的污染,使其转化为无毒的大气的成分。该反应的化学反应方程式为2CO+2NO 2CO2+N2;(5) Ksp=c(Ca2+)·c(CO32-)=2.8×10
2CO2+N2;(5) Ksp=c(Ca2+)·c(CO32-)=2.8×10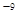 .由于溶液等体积混合后离子的浓度都减小一半,混合后c(CO32-)=5×10-5mol/L,所以Ca2+离子浓度的最小值是1/2c(Ca2+)×1/2×1×10
.由于溶液等体积混合后离子的浓度都减小一半,混合后c(CO32-)=5×10-5mol/L,所以Ca2+离子浓度的最小值是1/2c(Ca2+)×1/2×1×10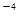 ≥2.8×10
≥2.8×10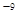 .解得c(Ca2+)≥1.12×10-4mol/L。
.解得c(Ca2+)≥1.12×10-4mol/L。
本题难度:一般
3、计算题 T℃时,有甲、乙两个密闭容器,甲容器的体积为1L,乙容器的体积为2L,分别向甲、乙两容器中加入6molA和3molB ,发生了如下反应:3A(g)+bB(g) 3C(g)+2D(g)? ΔH<0,后甲容器内的反应达到化学平衡,A的浓度为2.4mol·L-1,B的浓度为1.8mol·L-1;tmin后乙容器达到化学平衡,B的浓度为0.8mol·L-1。根据题目给的信息回答下列问题:
3C(g)+2D(g)? ΔH<0,后甲容器内的反应达到化学平衡,A的浓度为2.4mol·L-1,B的浓度为1.8mol·L-1;tmin后乙容器达到化学平衡,B的浓度为0.8mol·L-1。根据题目给的信息回答下列问题:
(1)甲容器中反应的平均速率v(B)=__________,化学方程式中计量系数b=__________。
(2)乙容器中反应达到平衡所需要的时间t__________(填“大于”“小于”或“等于”)4 min,原因是_______________________________。
(3)T ℃时,在另一个体积与乙容器相同的丙容器中,为了使达到平衡时B的浓度仍然为0.8 mol·L-1,起始时,向容器中加入C、D的物质的量分别为3 mol 、2 mol,则还需加入A、B的物质的量分别是:______________________。
(4)若要使甲、乙两容器中B的平衡浓度相等,可以采取的措施是__________。
A.保持温度不变,增大甲容器的体积至2 L
B.保持容器体积不变,使甲容器降低温度
C.保持容器压强和温度都不变,向甲中加入一定量的A气体
D.保持容器压强都不变,向甲中加入一定量的B气体
参考答案:
(1)0.3 mol·L-1·min-1? 1?
(2)大于?乙容器的体积大于甲容器的体积,反应物浓度减小,反应速率减慢,达到平衡所需要的时间就要长?
(3)3 mol、2 mol?
(4)ABC
本题解析:
(1)反应前,甲容器中A的浓度为6mol·L-1,4min甲容器内的反应达到化学平衡后,A的浓度减少了3.6mol·L-1,B的浓度减少了1.2mol·L-1,根据反应速率的计算公式结合化学反应方程式中各物质的化学反应速率之比等于化学计量数之比,可求出v(B)=0.3mol·L-1·min-1,b=1。
(2)乙容器的体积大于甲的,浓度小到达平衡的时间长。
(3)根据等效平衡规律,在恒温恒容下,转化为同一反应方向的物质的物质的量和原来对应相等即可。3molC、2molD完全转化后生成3molA和1molB,还需3molA和2molB。
(4)根据勒夏特列原理,结合等效平衡规律,可知A、B、C可行。
本题难度:简单
4、选择题 某一反应在一定条件下的平衡转化率为25.3%,其他条件不变,有一催化剂存在时,其转化率为
A.大于25.3%
B.小于25.3%
C.等于25.3%
D.约等于25.3%
参考答案:C
本题解析:考查外界条件对化学平衡状态的影响。催化剂能够同等程度改变正逆反应速率,所以使用催化剂不能改变平衡状态,即转化率是不变的,答案选C。
本题难度:困难
5、选择题 下图所示的直型石英玻璃封管中充有CO气体,左端放置不纯的镍(Ni)粉。在一定条件下,Ni可以与CO(g)发生如下反应:
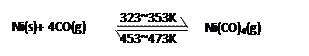

但Ni粉中的杂质不与CO(g)发生反应。玻璃管内左右两端的温度分别稳定在350K和470K,经过足够长时间后,下列说法正确的是
A.在石英管右端主要物质是Ni(CO)4(g)
B.在石英管右端主要物质是纯Ni(s)和CO(g)
C.在石英管左端主要物质是纯Ni(s)和CO(g)
D.整个过程可以看作CO(g)将Ni(s)从石英管左端转移到右端,从而达到提纯目的
参考答案:B D
本题解析:略
本题难度:简单