微信搜索关注"91考试网"公众号,领30元,获取公务员、事业编、教师等考试资料40G!
1、计算题 为了测定某铜银合金的成份,将30.0g合金溶于80ml13.5mol/L的浓硝酸中,待合金完全溶解后,收集到气体6.72L(标准状况),并测得溶液PH=0。假设反应后溶液的体积仍为80ml,试计算:
(1)被还原的硝酸的物质的量。
(2)合金中银的质量分数。
2、选择题 将一定体积的CO2通入VL NaOH溶液中,已知NaOH完全反应,若在反应后的溶液中加入足量石灰水,得到Ag沉淀;若在反应后的溶液中加入足量CaCl2溶液,得到Bg沉淀,则下列说法正确的是
[? ]
A.参加反应的CO2体积为0.224AL
B.用上述数据不能确定NaOH溶液的物质的量浓度
C.若A=B,则CO2与NaOH溶液反应的产物盐只有Na2CO3
D.B可能等于A、小于A或大于A
3、选择题 Na2O2与NaHCO3以质量比39:14混合,在密闭容器中充分加热,排除气体,冷却所得残余固体物质的是
[? ]
A. Na2O2和Na2CO3
B. Na2CO3和NaOH
C. Na2O2和NaOH
D. Na2CO3、Na2O2、NaOH
4、填空题 斯坦福大学R M. Trost教授提出了绿色化学的核心概念-原子经济性。我们常用原子利用率来衡量化学反应过程的原子经济性,其计算公式为:
原子利用率=
下面是新型自来水消毒剂ClO2的三种制取方法,请填空:
(1)氯酸钠和盐酸法:本方法的化学方程式为2NaClO3+4HCl==2NaCl+2ClO2↑+Cl2↑+2H2O,此方法的原子利用率为________%(保留一位小数)。
(2)电解亚氯酸钠法:本方法是用惰性电极电解亚氯酸钠溶液,原子利用率为62. 2%,其阳极的电极反应式为ClO2--e- ==ClO2↑,阴极的电极反应式为____。
(3)联合工艺法:本方法的反应原理由三步组成。
①电解热的氯化钠溶液:NaCl+3H2O NaClO3+3H2↑
NaClO3+3H2↑
②氢气和氯气合成氯化氢
③生成二氧化氯: 2NaClO3+4HCl==2NaCl+2ClO2↑+Cl2↑+2H2O
此方法的原子利用率最大为______%(保留一位小数)。
5、填空题 向100mLBaCl2、AlCl3、FeCl3的混合溶液A中逐滴加入Na2SO4和NaOH的混合溶液B,产生沉淀的物质的量n和加入溶液B的体积关系如下图所示
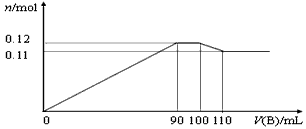
(1)当加入110mLB溶液时,溶液中的沉淀是___________(填化学式)。
(2)溶液B中Na2SO4和NaOH的物质的量浓度之比是____________。当B溶液加到90mL~100mL这一段时间中,所发生的离子反应方程式是_____________________、_____________________。
(3)将A、B溶液中各溶质的物质的量浓度(c)填入下表中。
