微信搜索关注"91考试网"公众号,领30元,获取公务员、事业编、教师等考试资料40G!
1、简答题 下表列出了①~⑤五种元素在周期表中的位置:

请按要求回答下列问题:
(1)元素④的原子结构示意图为______.
(2)元素①和③形成的化合物中的化学键是______共价键(填“极性”或“非极性”).
(3)元素①单质的电子式为______.
(4)元素②~⑤的原子半径由大到小的顺序为(填元素符号)______,它们的最高价氧化物对应的水化物中,酸性最强的是______(填化学式).
(5)元素②的单质在氧气中燃烧的产物与二氧化碳反应的化学方程式为______;元素③的最高价氧化物与烧碱溶液反应的离子方程式为______.
参考答案:根据元素在周期表中的位置知,①②③④⑤分别是N、Na、Si、S、Cl元素,
(1)元素④的原子核外有3个电子层,K、L、M电子层上电子数分别是2、8、6,其原子结构示意图为: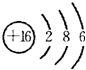 ,
,
故答案为: ;
;
(2)元素①和③形成的化合物是Si3N4,氮化硅中N和Si原子之间存在极性共价键,故答案为:极性;
(3)元素①单质是N2,氮原子之间存在氮氮三键,其电子式为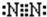 ,故答案为:
,故答案为: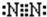 ;
;
(4)同一周期元素中,元素原子半径随着原子序数的增大而减小,所以原子半径大小顺序是Na>Si>S>Cl;同一周期元素中,元素的非金属性随着原子序数的增大而增强,元素的非金属性越强,其最高价氧化物的水化物酸性越强,这几种元素非金属性最强的元素是Cl元素,所以酸性最强的酸是HClO4,
故答案为:Na>Si>S>Cl;HClO4;
(5)Na在氧气中燃烧生成Na2O2,Na2O2与CO2反应生成Na2CO3和O2,反应方程式为:2Na2O2+2CO2=2Na2CO3+O2;元素③的最高价氧化物是SiO2,SiO2与NaOH溶液反应生成Na2SiO3和H2O,离子反应方程式为:SiO2+2OH-=SiO32-+H2O,故答案为:2Na2O2+2CO2=2Na2CO3+O2;SiO2+2OH-=SiO32-+H2O.
本题解析:
本题难度:一般
2、选择题 下列元素中,最高正化合价数值最大的是?
[? ]
A、C
B、S
C、F
D、Ne
参考答案:B
本题解析:
本题难度:简单
3、选择题 最近,美国普度大学的研究人员开发出一种利用铝镓合金加水制造氢气的新工艺.这项技术具有广泛的能源潜在用途,包括为汽车提供原料、潜水艇提供燃料等.该技术通过向铝镓合金注水,铝生成氧化铝,同时生成氢气.合金中镓(Ga,ⅢA)是关键成分,可阻止铝形成致密的氧化膜.下列关于铝、镓的说法正确的是( )
A.铝的金属性比镓强
B.铝的熔点比镓低
C.Ga(OH)3与Al(OH)3性质相似,一定能与NaOH溶液反应
D.铝、镓合金与水反应后的物质可以回收利用冶炼铝
参考答案:A、同主族元素从上到下金属性逐渐增强,金属性Ge>Al,故A错误;
B、二者都是金属晶体,离子半径Ge3+>Al3+,故金属Al中的金属键更强,故熔点Al>Ge,故B错误;
C、Ga的金属性比Al强,Ga(OH)3可能不表现为两性氢氧化物,故Ga(OH)3不一定与能与NaOH溶液反应,故C错误;
D、铝镓合金与水反应,铝生成氧化铝,可以回收氧化铝冶炼铝,故D正确;
故选D.
本题解析:
本题难度:一般
4、选择题 下列说法中,正确的是
[? ]
A.在周期表里,主族元素所在的族序数等于原子核外电子数
B.在周期表里,元素所在的周期数等于原子核外电子层数
C.最外层电子数为8的粒子都是稀有气体元素的原子
D.元素的原子序数越大,其原子半径也越大
参考答案:B
本题解析:
本题难度:简单
5、填空题 下表是元素周期表中短周期元素的一部分,表中所列字母分别代表一种元素.
(1)上述元素的单质中熔点最高的可能是______(填名称).
(2)D的氢化物比G的氢化物稳定,其原因是______的缘故.
(3)在一定条件下,A与E可形成一种极易溶于水的气态化合物,其电子式为______;该物质溶于水后的溶液呈______性(填“酸”、“碱”或“中”).
(4)元素C在元素周期表中位置第______周期?第______族
(5)“神舟”六号载人飞船内需要有一种化合物来吸收航天员呼出的CO2,你认为该物质应该是由上表中的______(填字母序号)元素组成的,用化学方程式表示吸收原理:
______.飞船中需要制造一种适合航天员生存的人工态环境,还应该在氧气中充入一种稀释气体,该气体化学式为______.
参考答案:根据元素在周期表中的位置,可以确定A是H,B是He,C是Na,D是C,E是N,F是O,G是Si,H是Cl.
(1)上述元素的单质中熔点最高的是属于原子晶体的金刚石,原子晶体的物质具有较高的熔点,故答案为:C;
(2)元素的非金属性C>Si,元素的非金属性越强则氢化物的稳定性越强,所以C的氢化物比Si的氢化物稳定,故答案为:D的非金属性比G强;
(3)在一定条件下,H与N可形成一种极易溶于水的气态化合物氨气,氨气是氮原子和氧原子间通过共价键形成的共价化合物,电子式为:

,氨气极易溶于水,其水溶液氨水显碱性,故答案为:

;碱;
(4)钠元素在周期表中位于第三周期,第ⅠA族,故答案为:三;ⅠA;
(5)有钠元素和氧元素组成的过氧化钠可以和二氧化碳反应生成氧气,2Na2O2+2CO2═2Na2CO3+O2,常被用作供氧剂,氮气是一种无毒的气体,常用作保护气,
故答案为:2Na2O2+2CO2═2Na2CO3+O2;N2.
本题解析:
本题难度:简单