微信搜索关注"91考试网"公众号,领30元,获取公务员、事业编、教师等考试资料40G!
1、选择题 在指定溶液中,下列各组离子一定能大量共存的是:?(?)
A.pH=1的溶液: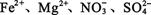
B.由水电离出的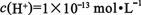 的溶液:
的溶液: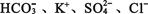
C.含大量Fe3+的溶液: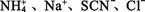
D.pH=13的溶液: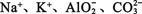
参考答案:D
本题解析:略
本题难度:简单
2、填空题 配平下列化学方程式:
(1)K2Cr2O7+HCl(浓)——KCl+CrCl3+Cl2↑+H2O
(2)Fe3C+HNO3(浓)——Fe(NO3)3+CO2↑+NO2↑+H2O
(3)Fe(OH)3+NaOH+Cl2——Na2FeO4+NaCl+H2O
(4)S+Ca(OH)2——CaSx+CaS2O3+H2O
(5)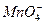 +H2S+H+——Mn2++S↓+H2O
+H2S+H+——Mn2++S↓+H2O
参考答案:(1)K2Cr2O7+14HCl(浓)====2KCl+2CrCl3+3Cl2↑+7H2O
(2)Fe3C+22HNO3(浓)====3Fe(NO3)3+CO2↑+13NO2↑+11H2O
(3)2Fe(OH)3+10NaOH+3Cl2====2Na2FeO4+6NaCl+8H2O
(4)2(x+1)S+3Ca(OH)2====2CaSx+CaS2O3+3H2O
(5)2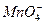 +5H2S+6H+====2Mn2++5S↓+8H2O
+5H2S+6H+====2Mn2++5S↓+8H2O
本题解析:(1)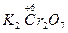 +H
+H 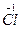 (浓)——KCl+
(浓)——KCl+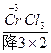 +
+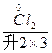 +H2O
+H2O
首s先确定CrCl3和Cl2的化学计量数分别是2和3,然后根据反应前后各种原子个数相等配平得:K2Cr2O7+14HCl(浓)====2KCl+2CrCl3+3Cl2↑+7H2O
逆配法:部分氧化还原反应、自身氧化还原反应、歧化反应等宜选用此种方法配平,即先从氧化产物和还原产物开始配平。
(2)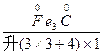 +
+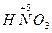 (浓)——
(浓)——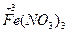 +
+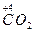 ↑+
↑+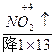 +H2O
+H2O
首先确定Fe3C和NO2的化学计量数分别是1和13,然后根据反应前后各种原子个数相等配平得:Fe3C+22HNO3(浓)====3Fe(NO3)3+CO2↑+13NO2↑+11H2O
零价法:对于不易确定元素化合价的物质(如铁、砷、碳等组成的化合物)参加的氧化还原反应,根据化合物中各元素的化合价代数和为零的原则,把组成该物质的各元素化合价看作零价,然后计算出各元素化合价的升降值,并使升降值相等。
(3)反应物中H∶O=1∶1,则Na2FeO4∶H2O=1∶4,设Na2FeO4的化学计量数为1,则H2O的化学计量数为4,根据反应前后各种原子个数相等配平得:
2Fe(OH)3+10NaOH+3Cl2====2Na2FeO4+6NaCl+8H2O
定组成法:对一个确定的化合物而言,各组成元素的原子个数之比一定,由此决定了反应物或生成物中可能有两种或两种以上的物质的比例关系一定,据此可实现配平。
(4)S0+Ca(OH)2——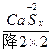 +
+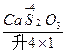 +H2O
+H2O
首先确定CaSx和CaS2O3的化学计量数分别是2和1,然后根据反应前后各种原子个数相等配平得:2(x+1)S+3Ca(OH)2====2CaSx+CaS2O3+3H2O
整体标价法:当化合物中某一元素有多个(或为不定数)时,可将它作为整体,计算其整体的化合价。
(5)第一步,根据得失电子守恒配平
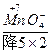 +
+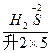 +H+——Mn2++
+H+——Mn2++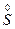 ↓+H2O
↓+H2O
则2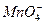 +5H2S+H+——2Mn2++5S↓+H2O
+5H2S+H+——2Mn2++5S↓+H2O
第二步,根据电荷守恒,两边离子电荷相等需要6个H+来配平,则:2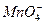 +5H2S+6H+——2Mn2++5S↓+H2O
+5H2S+6H+——2Mn2++5S↓+H2O
第三步,根据质量守恒配平得:2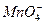 +5H2S+6H+====2Mn2++5S↓+8H2O
+5H2S+6H+====2Mn2++5S↓+8H2O
氧化还原型离子方程式的配平法:离子方程式的配平依据是得失电子守恒、电荷守恒和质量守恒,即首先根据得失电子守恒配平氧化剂、还原剂、氧化产物、还原产物的化学计量数,在此基础上根据电荷守恒,配平两边离子所带电荷数,最后根据质量守恒配平其余物质的化学计量数。
本题难度:简单
3、选择题 已知某温度下0.1 moL/L的NaHB溶液中c(H+)>c(OH-),则下列关系式一定正确的是
A.c(H+)+c(Na+)=c(HB-)+c(B2-)+c(OH-)
B.c(Na+)="0.1" moL/L≥c(B2-)
C.c(H+)×c(OH-)=1×10-14
D.溶液的pH = 1
参考答案:B
本题解析: A.根据电荷守恒解答;根据题意,NaHB是强电解质,溶液呈酸性,如果存在HB-,则 HB-?的电离程度大于水解程度,即?NaHB溶液中含有的离子是(Na+)、(H+)、c(HB-)、c(B2-)、c(OH-),根据电荷守恒得:c(Na+)+c(H+)=c(HB-)+2c(B2-)+c(OH-),故A错误;B.NaHB是强电解质,说明0.1mol/L的NaHB的溶液中c(Na+)=0.1mol/L.根据B项的分析,当HB-完全电离时,0.1mol/L的NaHB的c(B2-)=0.1mol/L,当HB-部分电离时,c(B2-)<0.1mol/L.因此,c(Na+)=0.1mol/L≥c(B2-),故B正确;C.根据HB-的电离情况讨论和pH的计算分析;在0.1mol/L的NaHB溶液中,无法求解氢离子的浓度,因而无法确定c(H+)-c(OH-)=10-14,但是可以知道c(H+)×c(OH-)=10-14,故C错误;D.根据HB-的电离情况讨论;NaHB是强电解质,溶液呈酸性,可能有两种情况,即HB-能够完全电离,也可能部分电离.当HB-完全电离时,0.1mol/L的NaHB的pH=1,当HB-部分电离时,0.1mol/L的NaHB的pH>1.故D错误;故选B。
点评:本题题目难度不大,考查离子浓度大小的比较;盐类水解的应用。
本题难度:一般
4、选择题 在无色透明的酸性溶液中,能大量共存的离子组是( )
A.Al3+、Na+、Cl