微信搜索关注"91考试网"公众号,领30元,获取公务员、事业编、教师等考试资料40G!
1、填空题 (13分) 2SO2(g)+O2(g) =2SO3(g)反应过程的能量变化如图所示。已知1mol SO2(g)氧化为1mol SO3的 ΔH=—99kJ·mol-1.请回答下列问题:
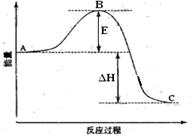
 (1)图中A、C分别表示 、
(1)图中A、C分别表示 、
(2) E的大小对该反应的反应热有无影响? 。该反应通常用V2O5作催化剂,加V2O5会使图中B点升高还是降低?
 (3)图中△H= KJ·mol-1;
(3)图中△H= KJ·mol-1;
 (4)V2O5的催化循环机理可能为:V2O5氧化SO2时,自身被还原为四价钒化合物;四价钒化合物再被氧气氧化。写出该催化循环机理的化学方程式:
(4)V2O5的催化循环机理可能为:V2O5氧化SO2时,自身被还原为四价钒化合物;四价钒化合物再被氧气氧化。写出该催化循环机理的化学方程式:
、
 (5)已知单质硫的燃烧热为296 KJ·mol-1,计算由S(s)生成3 molSO3(g)的△H (要求写出计算过程)。
(5)已知单质硫的燃烧热为296 KJ·mol-1,计算由S(s)生成3 molSO3(g)的△H (要求写出计算过程)。
参考答案:(1)反应物能量 生成物能量
(2)无 降低 因为催化剂改变了反应的历程使活化能E降低
(3)-198
(4)SO2+V2O5=SO3+2VO2 4VO2+O2=2V2O5 0.025 0.05
(5)-1185kJmol-1
本题解析: (1)根据图像可知,反应物总能量高于生成物总能量,所以为放热反应,由此可得到A和C所表示的意义,E为活化能与反应热无关,但是用催化剂可以降低活化能;
(1)根据图像可知,反应物总能量高于生成物总能量,所以为放热反应,由此可得到A和C所表示的意义,E为活化能与反应热无关,但是用催化剂可以降低活化能;
(2)图中表示的是2molSO2的反应,因此△H=-99×2KJ·mol-1;
(3)依题意即可写出:SO2 +V2O5=SO3+2VO2 4VO2+ O2=2V2O5;
(4)依据速率之比等于化学计量数之比计算即可。
(5)根据题意①S(s)+O2(g) =SO2(g) △H= —296KJ/mol,又因为②SO2(g)+1/2O2(g) =SO3(g) △H= —99kJ/mol。根据盖斯定律可知①+②即得到S(s)+3/2O2(g) =SO3(g) △H= —395KJ/mol,所以由S(s)生成3 molSO3(g)的△H=—395KJ/mol×3=-1185kJmol-1。
本题难度:一般
2、选择题 下列各组物质气化或熔化时,所克服的微粒间的作用(力) 属同种类型的是(?)
A.碘和干冰的升华
B.二氧化硅和生石灰的熔化
C.氯化钠和铁的熔化
D.氯化钠和氯化氢分别溶于水
参考答案:A
本题解析:A中形成的晶体是分子晶体,都是物理变化,克服的是分子间作用力;B中前者是原子晶体,克服的是共价键,后者是离子晶体,克服的是离子键。C中前者是离子晶体,克服的是离子键,后者是金属晶体,克服的是金属键。D中氯化氢是共价化合物,克服的是共价键,事宜答案选A。
点评:该题是中等难度试题的考查,试题难易适中,基础性强,侧重对学生基础知识的巩固和训练,旨在培养学生灵活运用基础知识解决实际问题的能力,难度不大。该题的关键是明确有关作用力的含义,特别是判断依据,然后结合题意灵活运用即可。
本题难度:一般
3、选择题 下列物质中,只含离子键的是( )
A.NH4Cl
B.KOH
C.HCl
D.NaCl
参考答案:A.NH4Cl含离子键和N-H共价键,故A不选;
B.KOH中含离子键和O-H共价键,故B不选;
C.HCl中只含H-Cl共价键,故C不选;
D.NaCl中只含钠离子与氯离子形成的离子键,故D选;
故选D.
本题解析:
本题难度:简单
4、填空题 (6分)能源是影响经济和生活的重要因素。目前人类已开发和利用的能源中,氢气是一种最理想的清洁能源。试填写下列空格。
(1)点燃氢气时,化学能主要转化为 ;
(2)氢气在原电池中反应时,化学能主要转化为 ;
(3)若在常温常压下,上述两种方式都反应1molH2,则放出的能量 (填“相同”或“不相同”)。
参考答案:⑴热能 ⑵电能 ⑶相同
本题解析:⑴物质燃烧是将化学能主要转化为热能;
⑵在原电池中是将化学能主要转化为电能;
⑶1molH2在燃烧或原电池过程中放出的能量是相同的,但能量的形式有所不同。
考点:考查化学反应与能量转化。
本题难度:一般
5、选择题 下列原子跟氢原子形成的化学键中,极性最强的是(?)。
A.F
B.Cl
C.N
D.O
参考答案:
本题解析:略
本题难度:简单