| 高考省级导航 | |
|
|
| 高考省级导航 | |
|
|
|
高考化学知识点总结《离子共存》试题巩固(2017年最新版)(八)
参考答案:B 本题解析:A、Fe3+与SCN-不共存,生成络合物硫氰化铁。B、可以共存。C、在酸性溶液中,碳酸氢根离子反应生成二氧化碳和水。D、硫酸根离子与钡离子反应生成硫酸钡沉淀。 本题难度:简单 3、选择题 能大量共存的一组离子是 |
参考答案:A
本题解析:A、离子之间均不反应,能够大量共存,正确;B、Fe2+ 具有还原性与酸性条件下 发生氧化还原反应,错误;C、H+ 与ClO- 生成次氯酸分子不能大量共存,错误;D、AlO2- 与HCO3- 发生双水解,生成氢氧化铝沉淀和二氧化碳气体,错误。
发生氧化还原反应,错误;C、H+ 与ClO- 生成次氯酸分子不能大量共存,错误;D、AlO2- 与HCO3- 发生双水解,生成氢氧化铝沉淀和二氧化碳气体,错误。
考点:离子反应及共存问题的判断。
本题难度:一般
4、选择题 现有一混合物的水溶液,可能含有以下离子中的若干种: K+、NH4+ 、Ba2+、CO32-、Cl-、SO42--。现取两份200 mL溶液进行如下实验:①第一份加足量NaOH溶液,加热,收集到气体1.36 g;②第二份加足量BaCl2溶液后,得干燥沉淀12.54 g,经足量盐酸洗涤、干燥后,沉淀质量为4.66 g。根据上述实验,以下推测正确的是
A.一定存在K+、NH4+、CO32-、SO42-,一定不存在Ba2+、Cl-
B.一定存在NH4+、Cl-、CO32-、SO42-,可能存在K+
C.c(SO42-)="0.2" mol·L-1,c(NH4+)>c(SO42-)
D.如果溶液中存在NH4+、Cl-、CO32-、SO42-、K+五种离子,则c(K+)>0.2 mol·L-1
参考答案:D
本题解析:由题干①中可知,收集到气体1.36 g一定是氨气,则n(NH4+ )="0.08" mol;由题干②中可知,不溶于盐酸的沉淀4.66 g为硫酸钡,物质的量为0.02 mol,另一种沉淀7.88 g为碳酸钡,物质的量为0.04 mol,原溶液n(CO32-)="0.04" mol,n(SO42-)="0.02" mol,不含有Ba2+,从一定含有的离子NH4+ 、CO32-、SO42-看,负电荷的物质的量大于正电荷的物质的量,一定含有钾离子,氯离子不确定,若没有氯离子,n(K+)="0.04" mol,当含有Cl-时,不论含多少Cl-,由电荷守恒可知n(K+)大于0.04 mol,又因体积为200 mL,c(K+)≥0.2 mol/L,选D。
考点:考查溶液中离子共存的判断。
本题难度:困难
5、选择题 根据表中信息,判断下列叙述中正确的是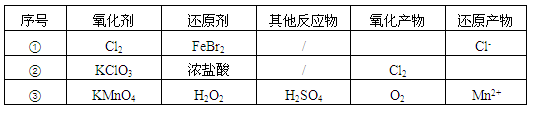
A.表中①组的反应只可能有一种元素被氧化和一种元素被还原
B.氧化性强弱的比较: KClO3>Fe3+>Cl2>Br2
C.由表中①②组反应推测:ClO3-、Br-、H+、Fe2+不能在浓溶液中大量共存
D.表中③组反应的离子方程式为:2MnO4-+ 3H2O2 + 6H+=2Mn2+ + 4O2↑+ 6H2O
参考答案:C
本题解析:A.表中①组的反应若Cl2过量,则发生反应:2Fe2++4Br-+3Cl2 = 2Fe3+ + 2Br2 + 6Cl-;若Cl2少量,则发生反应:2Fe2++Cl2 = 2Fe3++ 2Cl-;相对量的多少不同,被氧化的元素种类不同。错误。B.在氧化反应反应中,一般是氧化剂的氧化性大于氧化产物的氧化性。KClO3+6HCl(浓)  KCl+ 3Cl2↑+3H2O,证明氧化性:KClO3>Cl2;2NaBr+Cl2 =2NaCl+ Br2;证明氧化性:Cl2>Br2; 2FeBr2 + 2Br2= 2FeBr3,证明氧化性:Br2>Fe3+。因此氧化性KClO3>Cl2>Br2>Fe3+。错误。C.在浓溶液中ClO3-、Br-、H+、Fe2+会发生氧化反应反应而不能大量共存。正确。D.表中③组反应的离子方程式为:2MnO4-+ 5H2O2 + 6H+=2Mn2+ + 5O2↑+ 8H2O
KCl+ 3Cl2↑+3H2O,证明氧化性:KClO3>Cl2;2NaBr+Cl2 =2NaCl+ Br2;证明氧化性:Cl2>Br2; 2FeBr2 + 2Br2= 2FeBr3,证明氧化性:Br2>Fe3+。因此氧化性KClO3>Cl2>Br2>Fe3+。错误。C.在浓溶液中ClO3-、Br-、H+、Fe2+会发生氧化反应反应而不能大量共存。正确。D.表中③组反应的离子方程式为:2MnO4-+ 5H2O2 + 6H+=2Mn2+ + 5O2↑+ 8H2O
本题难度:一般
| 【大 中 小】【打印】 【繁体】 【关闭】 【返回顶部】 | |
| 下一篇:高中化学知识点讲解《电解质溶液.. | |