|
|
|
高考化学知识点总结《盐类水解的原理》考点特训(2017年冲刺版)(一)
2017-07-27 09:46:23
来源:91考试网
作者:www.91exam.org 【 大 中 小】
|
微信搜索关注"91考试网"公众号,领30元,获取公务员、事业编、教师等考试资料40G!
1、填空题 磷在自然界常以难溶于水的磷酸盐如Ca3(PO4)2等形式存在。它的单质和化合物有着广泛的应用。
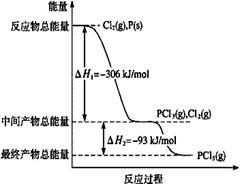
(1)红磷P(s)和Cl2(g)发生反应生成PCl3(g)和PCl5(g)。反应过程和能量关系如图所示(图中的△H表示生成1mol产物的数据)。
请回答问题:
①PCl5分解成PCl3和Cl2的热化学方程式是 。
②P和Cl2分两步反应生成1 mol PCl5的△H3= 。
(2)PCl5分解成PCl3和Cl2的反应是可逆反应。T℃时,向2.0 L恒容密闭容器中充入1.0 mol PCl5,经过250 s达到平衡。反应过程中测定的部分数据见下表:
t / s
| 0
| 50
| 150
| 250
| 350
| n(PCl3) / mol
| 0
| 0.16
| 0.19
| 0.20
| 0.20
|
①反应在50~150s 内的平均速率v(PCl3)= 。
②试计算该温度下反应的平衡常数(写出计算过程,保留2位有效数字)
(3)NaH2PO4、Na2HPO4和Na3PO4可通过H3PO4与NaOH溶液反应获得,含磷各物种的分布分数(平衡时某物种的浓度占各物种浓度之和的分数)与pH 的关系如图所示。
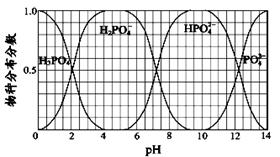
①为获得较纯的Na2HPO4,pH应控制在 ;pH=6时,溶液中主要含磷物种浓度大小关系为: 。
②Na2HPO4溶液呈碱性,加入足量的CaCl2溶液,溶液显酸性,溶液显酸性的原因是(从离子平衡角度分析) 。
2、选择题 将氨水缓缓地滴入盐酸中至中性,下列有关的说法:①盐酸过量 ②氨水过量 ③恰好完全反应 ④c (NH4+) = c(Cl-) ⑤c (NH4+) < c(Cl-) 正确的是
A.②④
B.③④
C.②⑤
D.①⑤
|
3、选择题 某一密闭绝热容器中盛有饱和Ca(OH)2溶液,当加入少量CaO粉末,下列说法正确的是
①有晶体析出 ②c[Ca(OH)2]增大 ③pH不变
④c(H+)·c(OH)-的积不变⑤c(H+)一定增大
A.①
B.①⑤
C.①②④
D.①③
|
4、填空题 (14分)某工业原料主要成分是NH4Cl、FeCl3和AlCl3。利用此原料可以得到多种工业产品。分析下面流程,回答问题。
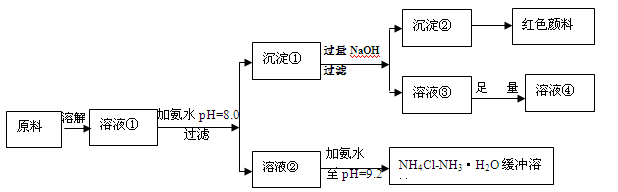
已知:Ksp[Fe(OH)3]=4.0×10-38
(1)用稀硫酸中和等体积等pH值的氨水和烧碱溶液,前者需要消耗的酸液体积 (填“大”“小”或“相同”)
(2)计算溶液②中Fe3+的物质的量浓度为 mol/L
(3)缓冲溶液中存在的平衡体系有: 、 、
此时溶液中c(NH4+) c(Cl-)(填>、=、<)。
(4)在缓冲溶液中加入少量盐酸或者NaOH溶液,溶液的pH值几乎依然为9.2。简述原理:
请举出另一种缓冲溶液的例子(写化学式) 。
(5)常温下向较浓的溶液④中不断通入HCl气体,可析出大量AlCl3·6H2O晶体,结合化学平衡移动原理解释析出晶体的原因: 。
5、选择题 下列溶液中粒子的物质的量浓度关系正确的是
A.0.1 mol/L NaHCO3溶液与0.1 mol/L NaOH溶液等体积混合,所得溶液中:c(Na+)>c(CO32-)>c(HCO3-)>c(OH-)
B.20 mL 0.1 mol/L CH3COONa溶液与10 mL 0.1 mol/L盐酸混合后呈酸性,所得溶液中:c(CH3COO-)>c(Cl-)>c(CH3COOH)>c(H+)
C.室温下,pH=2的盐酸与pH=12的氨水等体积混合,所得溶液中:c(Cl-)>c(H+)>c(NH4+)>c(OH-)
D.0.1 mol/L CH3COOH溶液与0.1 mol/L NaOH溶液等体积混合,所得溶液中:c(OH-)>c(H+)+c(CH3COOH)
