微信搜索关注"91考试网"公众号,领30元,获取公务员、事业编、教师等考试资料40G!
1、实验题 实验室用下图所示装置来制取乙酸乙酯,回答下列问题:

(1)请写出本实验中发生的主要反应方程式?。
(2)配置混合溶液时,加入试剂的正确顺序是?(填“A”或“B”)。
A.先加乙醇,再慢慢注入浓硫酸和乙酸? B.先加浓硫酸,再慢慢注入乙醇和乙酸
(3)浓硫酸的作用是?。
(4)饱和Na2CO3溶液的作用是?。
(5)实验完成后,右边试管液面上有透明的不溶于水的油状液体生成。若要分离10mL该液体混合物需要用到的主要玻璃仪器是?,这种分离方法叫做?。
参考答案:(8分)(1)CH3CH2OH+CH3COOH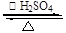 CH3COOCH2CH3+H2O?(2)A?
CH3COOCH2CH3+H2O?(2)A?
(3)催化剂和吸水剂?(4)中和乙酸,吸收乙醇,降低乙酸乙酯在水中的溶解度?(5)分液漏斗?分液
本题解析:(1)本实验中发生的主要反应方程式是乙酸与乙醇之间的酯化反应,方程式是CH3CH2OH+CH3COOH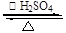 CH3COOCH2CH3+H2O.
CH3COOCH2CH3+H2O.
(2)由于浓硫酸溶于水放热,而乙醇和乙酸均是易挥发的,所以配置混合溶液时,加入试剂的正确顺序是先加乙醇,再慢慢注入浓硫酸和乙酸,答案选A。
(3)浓硫酸的作用是催化剂,又因为该反应是可逆反应,浓硫酸还起到吸水剂的作用,有利于反应向正反应方向进行。
(4)由于生成的乙酸乙酯中含有乙酸和乙醇,所以饱和Na2CO3溶液的作用是中和乙酸,吸收乙醇,降低乙酸乙酯在水中的溶解度。
(5)由于乙酸乙酯不溶于水,可以通过分液法实现分离,所以要分离10mL该液体混合物需要用到的主要玻璃仪器是分液漏斗。
点评:该题是基础性实验题的考查,试题紧扣教材,基础性强,旨在培养学生灵活运用基础知识解决实际问题的能力,有利于培养学生规范严谨的实验设计能力。明确实验原理,注意浓硫酸和碳酸钠的作用,注意相关知识的积累和总结。
本题难度:一般
2、选择题 用下图所示实验装置(夹持仪器已略去)探究铜丝与过量浓硫酸的反应。下列实验不合理的是

[? ]
A.上下移动①中铜丝可控制SO2的量
B.②中选用品红溶液验证SO2的生成
C.③中选用NaOH溶液吸收多余的SO2
D.为确认CuSO4生成,向①中加水,观察颜色
参考答案:D
本题解析:
本题难度:一般
3、简答题 以黄铁矿为原料生产硫酸的工艺流程图如下:

(1)将燃烧黄铁矿的化学方程式补充完整4______+11O2? ?2Fe2O3+8SO2
(2)接触室中发生反应的化学方程式是______.
(3)依据工艺流程图判断下列说法正确的是(选填序号字母)______.
a.为使黄铁矿充分燃烧,需将其粉碎b.过量空气能提高SO2的转化率
c.使用催化剂能提高SO2的反应速率和转化率d.沸腾炉排出的矿渣可供炼铁
(4)吸收塔排出的尾气先用氨水吸收,再用浓硫酸处理,得到较高浓度的SO2和铵盐.SO2既可作为生产硫酸的原料循环再利用,也可用于工业制溴过程中吸收潮湿空气中的Br2.SO2吸收Br2的离子方程式是______.
(5)将0.050mol?SO2(g)和0.030mol?O2(g)放入容积为1L的密闭容器中,反应在一定条件下达到平衡,测得c(SO3)=0.040mol/L.则该条件下SO2的平衡转化率为______.
(6)将黄铁矿的煅烧产物Fe3O4溶于H2SO4后,加入铁粉,可制备FeSO4.酸溶过程中需保持溶液足够酸性,其原因是______.
参考答案:(1)依据题意,黄铁矿是制硫酸的第一步所需的原料,由成分可知化学式为FeS2,故答案为:FeS2;
(2)沸腾炉中生成的二氧化硫气体和空气中的氧气在接触室内发生的催化氧化反应生成三氧化硫;2SO2+O2催化剂.△2SO3?故答案为:2SO2+O2催化剂.△2SO3;
(3)粉碎矿石增大接触面积提高反应速率;增加空气的量会使平衡正向进行,提高了二氧化硫的转化率;催化剂只改变速率不改变平衡,不改变转化率;生产过程中的矿渣中含有三氧化二铁;所以正确的是abd;故答案为:abd;
(4)SO2吸收Br2的反应中二氧化硫被氧化为硫酸,溴单质被还原为溴化氢,离子方程式为SO2+Br2+2H2O=4H++2Br-+SO42-,故答案为:SO2+Br2+2H2O=4H++2Br-+SO42-;
(5)平衡时生成三氧化硫的物质的量为0.040mol,根据化学平衡计算如下:
? 2SO2 +O2催化剂.△2SO3
起始量? 0.05mol? 0.03mol? 0
变化量?0.040mol?0.02mol?0.040mol
平衡量? 0.01mol? 0.01mol? 0.04mol
二氧化硫的转化率=0,040.05×100%=80%,
故答案为:80%;
(6)将黄铁矿的煅烧产物Fe3O4溶于H2SO4后,加入铁粉,是防止亚铁盐被氧化,可制备FeSO4.酸溶过程中需保持溶液足够酸性,防止Fe2+、Fe3+的水解,
故答案为:抑制Fe2+、Fe3+的水解,防止Fe2+被氧化成Fe3+.
本题解析:
本题难度:一般
4、填空题 酸奶中含有乳酸,其结构简式为
CH3—CH(OH)—COOH。
(1)乳酸跟足量金属钠反应的化学方程式为:_______________________________________。
(2)乳酸跟少量碳酸钠溶液反应的化学方程式为:_________________________________。
(3)乳酸在浓硫酸的存在下,3分子相互反应,生成物为链状,其结构简式可表示为:
______________________________________________________________________________。
(4)乳酸在浓硫酸存在下,2分子相互反应,生成物为环状,其结构简式为:
______________________________________________________________________________。
参考答案:(1)CH3—CH(OH)—COOH+2Na CH3—CH(ONa)—COONa +H2↑ CH3—CH(ONa)—COONa +H2↑
(2) 2CH3—CH(OH)—COOH+Na2CO3 2CH3—CH(OH)—COONa+CO2↑+H2O 2CH3—CH(OH)—COONa+CO2↑+H2O
(3)CH3—CH(OH)—COOCH(CH3)COOCH(CH3)COOH

本题解析:(1)—OH和—COOH与钠均能发生反应,据此可写出反应的化学方程式。
(2)—COOH与Na2CO3反应放出CO2,而—OH与Na2CO3不反应,据此可写出反应的化学方程式。
(3)3分子乳酸在浓硫酸存在下,一分子中的—COOH与另一分子中的—OH酯化,相互作用可生成链状酯。
(4)2分子乳酸在浓硫酸存在下,2分子中的—OH和—COOH相互酯化,可生成环状交酯。
本题难度:简单
5、选择题 下列有关乙酸的性质的叙述错误的是:
A.乙酸分子中含有的官能团是羧基
B.乙酸俗称酒精
C.乙酸与苏打(碳酸钠)作用会有气泡产生
D.在发生酯化反应时,乙酸分子中的羟基跟醇分子中羟基上的氢原子结合成水分子
参考答案:B
本题解析:略
本题难度:简单
|