微信搜索关注"91考试网"公众号,领30元,获取公务员、事业编、教师等考试资料40G!
1、选择题 俗名和化学式符合的是(?)
①纯碱NaCl?②苛性钠Na?③苏打NaHCO3?④烧碱 NaOH⑤芒硝Na2SO4·10H2O
A.①②
B.③④
C.②③
D.④⑤
参考答案:D
本题解析:记清某些物质的俗名是解答本题的关键。纯碱是Na2CO3,火碱、烧碱、苛性钠都是NaOH,苏打是Na2CO3,小苏打是NaHCO3。
本题难度:简单
2、填空题 (15分)材料在人类生活、生产中发挥着重要的作用。
(1)钠、铝、铁是常见的金属。
①在三种金属元素中,所形成氧化物种类最多的是?;三种元素形成的氧化物中属于碱性氧化物的有?种。
②向盛有硫酸铝溶液的试管中滴加氨水,反应的离子方程式为?,
得到的胶状沉淀物在医疗上治疗胃酸过多,利用的原理用离子方程式表示为?。
③向盛有氯化铁、氯化亚铁、氯化铜混合溶液的烧杯中加入铁粉和铜粉,反应结束后,剩余固体中有铜无铁,则溶液中一定存在的阳离子为?,可能存在的阳离子为?,一定不存在的阳离子为?。
④生产中曾用铝热反应(铝与铁的氧化物反应生成氧化铝和铁)焊接钢轨,则铝与氧化铁发生反应的化学方程式为 ? ,要得到1mol金属铁,需要铝的质量 g。
(2)工业上,在电炉中用炭粉还原二氧化硅可制得硅和一氧化碳。若向电炉里加入适量炭粉和30g二氧化硅,通电后反应,生成的一氧化碳在标况下的体积为?。
参考答案:(1)① Fe或铁(1分);3(1分)
② Al3+ + 3NH3.H2O = Al(OH)3↓+ 3NH4+(2分);Al(OH)3 + 3H+? = Al3+ + 3H2O(2分)
③Fe2+(1分),Cu 2+(1分),Fe3+(1分)
④2Al + Fe2O3? =?Al2O3+ 2Fe(2分) ,27(2分)
(2)22.4L(2分)
本题解析:(1)钠、铝、铁是常见的金属。
①在三种金属元素中,所形成氧化物种类最多的是铁;三种元素形成的氧化物中属于碱性氧化物的有3种。
②向盛有硫酸铝溶液的试管中滴加氨水,反应的离子方程式为Al3+ + 3NH3.H2O = Al(OH)3↓+ 3NH4+,Al(OH)3不和弱碱反应;
得到的胶状沉淀物在医疗上治疗胃酸过多,胃酸是盐酸,利用的原理用离子方程式表示为Al(OH)3 + 3H+? = Al3+ + 3H2O。
③向盛有氯化铁、氯化亚铁、氯化铜混合溶液的烧杯中加入铁粉和铜粉,反应结束后,剩余固体中有铜无铁,则溶液中一定存在的阳离子为Fe2+,可能存在的阳离子为Cu 2+,一定不存在的阳离子为Fe3+。,有铜剩余,就一定不会有三价铁;
 ④生产中曾用铝热反应(铝与铁的氧化物反应生成氧化铝和铁)焊接钢轨,则铝与氧化铁发生反应的化学方程式为2Al + Fe2O3? =?Al2O3+ 2Fe,要得到1mol金属铁,由定量关系可得需要铝的物质的量是1mol,所以质量是27g。
④生产中曾用铝热反应(铝与铁的氧化物反应生成氧化铝和铁)焊接钢轨,则铝与氧化铁发生反应的化学方程式为2Al + Fe2O3? =?Al2O3+ 2Fe,要得到1mol金属铁,由定量关系可得需要铝的物质的量是1mol,所以质量是27g。
(2)工业上,在电炉中用炭粉还原二氧化硅可制得硅和一氧化碳。
 ?
?
SiO2? +? 2C? =? 2CO↑?+? Si
60?2×22.4
30? x
X=22.4
所以向电炉里加入适量炭粉和30g二氧化硅,通电后反应,生成的一氧化碳在标况下的体积为22.4L。
点评:本题考查是无机物之间的反应的问题,要求学生熟悉常见的物质间的反应,会用定量关系进行计算。
本题难度:一般
3、选择题 在2 L含有Na2CO3和Na2SO4的混合溶液中,加入过量BaCl2溶液,生成43.0g白色沉淀,再加入过量稀硝酸,沉淀减少到23.3g,则下列说法错误的是
A.生成BaSO4的物质的量为0.1mol
B.原溶液中碳酸钠的物质的量浓度为0.1mol?L-1
C.生成的气体在标况下的体积为2.24L
D.消耗的氯化钡的质量为41.6g
参考答案:B
本题解析:略
本题难度:简单
4、填空题 (12分)在两份体积相同的NaOH溶液中,分别通入CO2气体,充分反应后,在所得溶液A、B中分别加入1mol/L的盐酸,所加盐酸体积(mL)与产生CO2气体的体积(L)的关系如图所示,试填写下列空白:

⑴两份NaOH溶液A和B的物质的量浓度之比为?,通入CO2气体的体积之比是(相同条件)?。
⑵与盐酸反应前,A溶液中的溶质是?,其物质的量之比是?。
⑶与盐酸反应前,B溶液中的溶质是?,其物质的量之比是?。
参考答案:
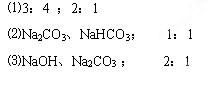
本题解析:略
本题难度:一般
5、填空题 (12分)金属钠在氧气中充分燃烧生成产物是?色,将所得产物投入水中,产物和水迅速发生反应,写出该反应的化学方程式:?。向上所得溶液中加入FeSO4溶液,看到的现象:?,此过程中发生的氧化还原反应的化学方程式:?。
参考答案:(1)淡黄色?2Na2O2 + 2H2O ="=" 4NaOH+ O2 ↑?
(2)生成白色沉淀,迅速变灰绿色,最后变红褐色。
4Fe(OH)2 + O2 +2H2O ="=" 4Fe(OH)3
本题解析:略
本题难度:简单