| 高考省级导航 | |
|
|
| 高考省级导航 | |
|
|
|
高考化学试题《离子方程式的书写及正误判断》考点预测(2017年强化版)(八)
(4)实验室制得的Na2S2O3粗晶体中往往含有少量杂质。为了测定粗产品中Na2S2O3·5H2O的含量,一般采用在酸性条件下用KMnO4标准液滴定的方法(假定粗产品中杂质与酸性KMnO4溶液不反应)。 称取1.28 g的粗样品溶于水,用0.40mol/L KMnO4溶液(加入适量硫酸酸化)滴定,当溶液中S2O32—全部被氧化时,消耗KMnO4溶液体积20.00 mL。 (5S2O32—+8MnO4—+14H+ =8Mn2++10SO42—+7H2O)。试回答: ①此滴定实验是否需要指示剂 (填“是”或“否”),KMnO4溶液置于 (填“酸式”或“碱式”)滴定管中。 ②若滴定时振荡不充分,刚看到溶液局部变色就停止滴定,则会使样品中Na2S2O3·5H2O的质量分数的测量结果会 (填“偏高”“偏低”或“不变”)。 ③产品中Na2S2O3·5H2O的质量分数为 。(Na2S2O3·5H2O式量:248)(保留小数点后两位数) 参考答案:(1)SO2+OH—=HSO3—;因有HSO3—存在,HSO3— 本题解析:(1)由已知:n(NaOH)=1mol?L-1 × 0.1L=0.1mol 本题难度:困难 3、选择题 某溶液中可能含有H+、Na+、NH4+、Mg2+、Fe3+、Al3+、SO42-、HCO3-等离子。当向该溶液中加入一定物质的量浓度的NaOH溶液时,发现生成沉淀物质的量随NaOH溶液的体积变化如图所示,下列说法正确的是 |
参考答案:C
本题解析:由图可知,该溶液中存在氢离子,则一定不存在碳酸氢根离子;所以溶液中的阴离子只能是硫酸根离子;加入NaOH溶液时,oa段发生氢离子与氢氧根离子的中和反应生成水;再加入氢氧化钠溶液,则与某些离子产生沉淀,后沉淀部分溶解,说明原溶液中存在Al3+,同时存在Mg2+、Fe3+中的一种或两种;根据溶解氢氧化铝消耗的氢氧化钠与生成氢氧化铝消耗的氢氧化钠的体积比是1:3,所以产生另一种沉淀也消耗与产生氢氧化铝等量的氢氧化钠,且生成的沉淀的物质的量相等,所以该离子为+3价离子,所以一定含有铁离子,无镁离子;bc段沉淀未溶解,所以此时的氢氧根离子与铵根离子反应生成一水合氨,说明溶液中存在铵根离子。A、根据以上分析,ab段发生的离子反应为:Al3++3OH-= Al(OH)3↓,Fe3++3OH-= Fe(OH)3↓,错误;B、原溶液中含有的阳离子必定有H+、NH4+、Al3+、Fe3+,错误;C、生成的沉淀的物质的量相等,所以原溶液中含有的Fe3+和Al3+的物质的量之比为1:1,正确;D、因为溶液中存在硫酸根离子,所以d点时溶液中含有的溶质有NaAlO2和硫酸钠,错误,答案选C。
考点:考查结合图象分析溶液中离子的成分,离子的检验与计算
本题难度:困难
4、选择题 下列反应的离子方程式正确的是
A.AlCl3溶液中加入过量氨水:Al3++4NH3·H2O===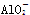 +2H2O+
+2H2O+
B.硫化钠的水解反应:S2-+2H2O H2S+2OH-
H2S+2OH-
C.将等体积等物质的量浓度的NaHCO3溶液与Ba(OH)2溶液混合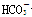 +Ba2++OH-===BaCO3↓+H2O
+Ba2++OH-===BaCO3↓+H2O
D.单质铜与稀硝酸反应:Cu+2H++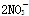 ===Cu2++2NO↑+H2O
===Cu2++2NO↑+H2O
参考答案:C
本题解析:A、生成的是氢氧化铝而不是偏铝酸根离子,A错;B、S2- + H2O = HS- + OH-,B错;
C、NaHCO3+Ba(OH)2=NaOH+BaCO3+H2O,C正确;D、电荷不守恒,D错;故答案选C
考点:考查离子反应的相关知识点,难度适中。
本题难度:一般
5、填空题 为证明Fe3+具有较强的氧化性,甲同学做了如下实验:将Cu片放入0.5mol/L Fe(NO3)3溶液中,观察到Cu片逐渐溶解,溶液由黄色变为蓝绿色,由此甲同学得到Fe3+具有较强氧化性的结论。
乙同学提出了不同的看法:“Fe(NO3)3溶液具有酸性,在此酸性条件下NO3-也能氧化Cu”,并设计实验进行探究。已知:
| 水解反应 | 平衡常数(K) |
Fe3+ + 3H2O  Fe(OH)3 + 3H+ Fe(OH)3 + 3H+ | 7.9 × 10-4 |
Fe2+ + 2H2O  Fe(OH)2 + 2H+ Fe(OH)2 + 2H+ | 3.2 × 10-10 |
Cu2+ + 2H2O  Cu(OH)2 + 2H+ Cu(OH)2 + 2H+ | 3.2 × 10-7 |
| 实验内容 | 实验现象 |
| 甲同学的实验方案 | 溶液逐渐变成蓝绿色, pH略有上升 |
| 乙同学的实验方案 | 无明显现象,pH没有明显变化。 |
参考答案:(1)3Cu + 8HNO3 = 3Cu(NO3)2 + 2NO↑ + 4H2O (2分)
(2)测定硝酸铁溶液的pH,再用硝酸钠溶液和稀盐酸配制成与硝酸铁溶液PH相同、硝酸根离子浓度相同的溶液,将铜片加入到该溶液中,观察二者是否反应。(3分)
(3)①Cu + 2Fe3+ = Cu2+ + 2Fe2+ (2分)
②Fe3+变为Cu2+和Fe2+,水解能力下降(2分)
③在此酸性条件下NO3-不能氧化Cu。(2分)
(4)将铜片放入0.5mol/L氯化铁溶液中(2分)
本题解析:
(1)稀硝酸和Cu反应的化学方程式为3Cu + 8HNO3 = 3Cu(NO3)2 + 2NO↑ + 4H2O
(2)乙同学认为Fe(NO3)3溶液具中的NO3-也能氧化Cu,据此设计对照实验,配制pH与Fe(NO3)3溶液相同但只含NO3-不能氧化CuNO3-不含Fe3+的溶液即可,将铜放入该溶液中,观察二者是否反应
(3)①根据丙同学的实验证明甲同学的结论是正确的,发生的离子反应方程式为Cu + 2Fe3+ = Cu2+ + 2Fe2+②根据水解反应的平衡常数知Fe3+水解程度最大,溶液的pH略有上升,说明Fe3+变为Cu2+和Fe2+浓度减小,水解能力下降
③乙同学的实验现象说明在Fe(NO3)3溶液的酸性条件下,NO3-不能氧化Cu
(4)甲同学的实验中,NO3-造成干扰,将原溶液中的NO3-换成其他易溶盐的酸根离子即可证明
本题难度:一般
| 【大 中 小】【打印】 【繁体】 【关闭】 【返回顶部】 | |
| 下一篇:高考化学知识点总结《氯及其化合.. | |