微信搜索关注"91考试网"公众号,领30元,获取公务员、事业编、教师等考试资料40G!
1、计算题 (6分)已知反应:3Cl2+8NH3==N2+6NH4Cl
(1)参加反应的NH3和作为还原剂的NH3的个数比为多少?
(2)若标准状况下33.6LCl2参加反应则被氧化的NH3的质量为多少?将还原产物溶于水配成500ml溶液其物质的量浓度为多少? (有计算步骤)
参考答案:(6分)(1)4:1(2分)
(2)3Cl2→2NH3(被氧化)
3mol 2х17g
1.5mol m 得m=17g (2分)
3Cl2→6NH4Cl
3mol 6mol
1.5mol n 得n=3mol c(NH4Cl)=6mol/L(2分)
本题解析:(1)根据方程式可知:在参加反应的8mol的NH3中有2mol的化合价升高,失去电子,被氧化,作还原剂,6mol的NH3的化合价没有发生变化,因此参加反应的NH3和作为还原剂的NH3的个数比为8:2=4:1;(2) n(Cl2)= 33.6L÷22.4L/mol=1.5mol,根据方程式可知每3mol的氯气参加反应,2mol的氨气被氧化,现在参加反应的氯气的物质的量是1.5mol,所以被氧化的氨气的质量是:(1.5mol×2 ×17 g/mol)÷3=17g;根据Cl元素守恒可得关系式:3Cl2→6NH4Cl。n(Cl2)= 1.5mol,所以n(NH4Cl)= 3mol,所以c(NH4Cl)=3mol÷0.5L=6mol/L.
考点:考查在氧化还原反应中物质的作用、守恒法在化学反应及计算中的应用的知识。
本题难度:一般
2、选择题 下列说法正确的是
A.氧化还原反应一定有氧元素参加
B.失电子难的原子其得电子的能力一定强
C.金属单质只具有还原性
D.失电子越多,该物质的还原性就越强
参考答案:C
本题解析:A.氧化还原反应不一定有氧元素参加,错误;B.失电子难的原子其得电子的能力不一定强,错误;C.金属单质只能失去电子,因此具有还原性,正确;? D.该物质的还原性的强弱不能看失电子的多少,错误。
本题难度:一般
3、填空题 (5分)请把符合要求的化学方程式的编号填入直线上。
(1)既属于分解反应又是氧化还原反应的是??。
(2)属于化合反应,但不是氧化还原反应的是??。
(3)既属于化合反应,又是氧化还原反应的是??。
(4)属于分解反应,但不是氧化还原反应的是??。
(5)不属于四 种基本反应类型的氧化还原反应的是??。
种基本反应类型的氧化还原反应的是??。
A.2NaHCO3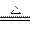 Na2CO3+H2O+CO2↑
Na2CO3+H2O+CO2↑
B.2Na+Cl2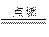 2NaCl
2NaCl
C.Zn+CuSO4=ZnSO4+Cu
D.2KMnO4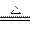 K2MnO4+MnO2+O2↑
K2MnO4+MnO2+O2↑
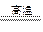 2Fe2O3+8SO2
2Fe2O3+8SO2