微信搜索关注"91考试网"公众号,领30元,获取公务员、事业编、教师等考试资料40G!
1、选择题 Na2O2是一种淡黄色固体,常用作潜水艇的供氧剂.下列关于Na2O2的描述正确的是
A.Na2O2晶体中阴阳离子个数之比为1:1
B.Na2O2晶体中既有离子键又有非极性共价键
C.Na2O2在空气中加热可以得到更稳定的Na2O
D.Na2O2长期露置于空气中最终转变成NaOH
参考答案:B
本题解析:分析:A.Na2O2晶体中中阳离子为Na+、阴离子为O22-;
B.一般金属元素与非金属元素形成离子键,同种非金属元素之间形成非极性键,不同种非金属元素之间形成极性共价键;
C.Na2O2比Na2O稳定;
D.Na2O2易与水反应生成NaOH,NaOH吸收空气中的水和CO2生成Na2CO3?xH2O,Na2CO3?xH2O风化脱水生成Na2CO3.
解答:A.Na2O2晶体中中阳离子为Na+、阴离子为O22-,所以Na2O2晶体中阴阳离子个数之比为1:2,故A错误;
B.过氧化钠中钠离子和过氧根离子间存在离子键,过氧根离子中氧原子和氧原子之间存在非极性共价键,故B正确;
C.Na2O2比Na2O稳定,所以Na2O在空气中加热可以得到更稳定的Na2O2,故C错误;
D.Na2O2易与水反应生成NaOH,NaOH吸收空气中的水和CO2生成Na2CO3?xH2O,Na2CO3?xH2O风化脱水生成Na2CO3,故D错误;
故选B.
点评:本题主要考查了Na2O2的组成与结构、化学性质等,难度不大,根据课本知识即可完成.
本题难度:一般
2、选择题 下列物质中,不能与氢氧化钠溶液发生反应的是
A.Fe
B.Al2O3
C.NaHCO3
D.CO2
参考答案:A
本题解析:Al2O3是两性氧化物,可与碱反应。NaHCO3在溶液里电离出HCO3-,也是既可与碱反应,也能与酸反应。CO2是酸性氧化物,可与NaOH反应。一般情况下,很少有金属直接与碱作用。所以正确答案为A。
本题难度:简单
3、选择题 将金属钠分别投入下列物质的稀水溶液中,能生成白色沉淀的是
A.HCl
B.K2SO4
C.MgCl2
D.CuCl2
参考答案:C
本题解析:分析:金属钠分别投入盐的水溶液中,钠和水发生:2Na+2H2O=2NaOH+H2↑,根据NaOH的性质判断.
解答:A.发生:2Na+2HCl=2NaCl+H2↑,没有沉淀生成,故A不选;
B.钠和水发生:2Na+2H2O=2NaOH+H2↑,NaOH和K2SO4不反应,故B不选;
C.钠和水发生:2Na+2H2O=2NaOH+H2↑,NaOH和MgCl2反应生成氢氧化镁白色沉淀,故C选;
D.钠和水发生:2Na+2H2O=2NaOH+H2↑,NaOH和CuCl2反应生成氢氧化铜蓝色沉淀,故D不选;
故选C.
点评:本题考查钠的性质,题目难度不大,注意把握钠的水的反应,学习中注意相关基础知识的积累.
本题难度:一般
4、选择题 下列说法正确的是
①碳酸钠不能一步转化为碳酸氢钠;
②常温下所有金属都能与盐酸反应;
③在空气中铝制品比铁制品更不易被锈蚀,原因是铝不能与氧气发生反应;
④将一小块钠投入到FeCl3溶液中,观察到的现象是钠溶解,有铁析出并有气体生成;
⑤纯碱和熟石灰都是碱;
⑥NaCl和KCl可用焰色反应鉴别.
A.③⑥
B.①⑤
C.⑤⑥
D.⑥
参考答案:D
本题解析:分析:①根据碳酸钠与二氧化碳、水反应能生成碳酸氢钠;
②根据常温下金属铜、银能与盐酸不反应;
③根据铝的化学性质比较活泼,可以和空气中的氧气反应生成氧化铝,在铝的表面形成一层致密的氧化物薄膜,从而表现出良好的抗腐蚀性能;
④将一小块钠投入到FeCl3溶液中,先发生钠与水反应,然后生成的碱再与FeCl3反应;
⑤根据纯碱是碳酸钠,碳酸钠是由钠离子和碳酸根离子组成的化合物,属于盐;
⑥根据含钠元素的物质和含有钾元素的物质焰色反应不同;
解答:①碳酸钠与二氧化碳、水反应能生成碳酸氢钠,所以碳酸钠能一步转化为碳酸氢钠,故①错误;
②因常温下金属铜、银能与盐酸反应,故②错误;
③因铝的化学性质比较活泼,可以和空气中的氧气反应生成氧化铝,在铝的表面形成一层致密的氧化物薄膜,从而表现出良好的抗腐蚀性能,故③错误;
④将一小块钠投入到FeCl3溶液中,将Na投入FeCl3溶液中,发生的反应为:2Na+2H2O=2NaOH+H2↑,3NaOH+FeCl3=Fe(OH)3↓+3NaCl,所以看到的现象是:有气体、红褐色沉淀产生,不会有铁析出,故④错误;
⑤纯碱是碳酸钠,碳酸钠是由钠离子和碳酸根离子组成的化合物,属于盐,故⑤错误;
⑥含钠元素的物质焰色反应为黄色,含有钾元素的物质焰色反应透过蓝色的钴玻璃为紫色,所以进行焰色反应鉴别KCl溶液和NaCl溶液,故⑥正确;
故选:D;
点评:本题主要考查了物质的性质,掌握物质的性质是解题的关键,注意知识的积累,难度不大.
本题难度:困难
5、选择题 现有下列物质?①2.3g?Na?②6.2g?Na2O?③7.8g?Na2O2?④4.0g?NaOH,把它们分别放入100g水中,对所得的溶液的质量分数中正确的是
A.③>②>①>④
B.③=②>①>④
C.④>③>②>①
D.③=②>④=①
参考答案:B
本题解析:分析:先根据化学反应方程式确定溶质,再根据溶液质量的变化计算质量分数.
解答:①2.3g?Na与水反应生成氢氧化钠和氢气,所以溶液中溶质是氢氧化钠;根据化学式Na→NaOH知,生成氢氧化钠的质量为4g,溶液的质量=钠和水的质量-氢气的质量=2.3g+100g-0.1g=102.2g,所以该溶液的质量分数 ;
;
②6.2g?Na2O与水反应生成氢氧化钠,溶液中的溶质是氢氧化钠;根据化学式Na2O→NaOH知,生成氢氧化钠的质量为8g,溶液的质量=氧化钠和水的质量=6.2g+100g=106.2g,所以该溶液的质量分数为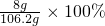 =7.5%;
=7.5%;
?③7.8g?Na2O2与水反应生成氢氧化钠和氧气,所以溶液中的溶质是氢氧化钠;根据化学式Na2O2→NaOH知,生成氢氧化钠的质量为8g,溶液的质量=过氧化钠+水的质量-氧气的质量=7.8g+100g-1.6g=106.2g,所以该溶液的质量分数为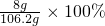 =7.5%;
=7.5%;
?④4.0g?NaOH溶于水和水不反应,所以溶液的溶质为氢氧化钠,溶液的质量=氢氧化钠的质量+水的质量=4.g+100g=104g,所以溶液的质量分数为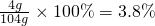 .
.
所以溶液的质量分数正确的是③=②>①>④,故选B.
点评:本题考查了物质之间的反应及溶液溶质的判断,难度不大,要注意溶液质量的计算,正确确定溶质的质量、溶液的质量是解本题的关键.
本题难度:困难