微信搜索关注"91考试网"公众号,领30元,获取公务员、事业编、教师等考试资料40G!
1、选择题 铋(Bi)在医药方面有重要应用。下列关于 i和
i和 的说法正确的是
的说法正确的是
A. i和
i和 都含有83个中子
都含有83个中子
B. 和
和 互为同位素
互为同位素
C. i和
i和 的核外电子数不同
的核外电子数不同
D. i和
i和 都含有83个质子,是同一种核素
都含有83个质子,是同一种核素
参考答案:B
本题解析:在表示原子组成时元素符号的左下角表示质子数,左上角表示质量数。A、因为质子数和中子数之和是质量数,所以 和
和 含有的中子数分别是209-83=126、210-83=128,A不正确;B、
含有的中子数分别是209-83=126、210-83=128,A不正确;B、 和
和 的质子数相同,但中子数不同,二者互为同位素,B正确;C、
的质子数相同,但中子数不同,二者互为同位素,B正确;C、 和
和 的质子数相同,由于质子数=核外电子数,所以二者的核外电子数也是相同的,C不正确;D、
的质子数相同,由于质子数=核外电子数,所以二者的核外电子数也是相同的,C不正确;D、 和
和 都含有83个质子,但中子数不同,属于不同种核素,D不正确,答案选B。
都含有83个质子,但中子数不同,属于不同种核素,D不正确,答案选B。
本题难度:一般
2、选择题 已知X、Y、Z三种主族元素在周期表中的相对位置如图所示,且X的原子序数为a,下列说法中不正确的是
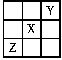
A.Y、Z的原子序数之和可能是2a
B.Y的原子序数可能是a—17
C.Z的原子序数可能是a+31
D.X、Y、Z一定都是短周期元素
参考答案:D
本题解析:略
本题难度:一般
3、推断题 (12分)有A、B、C、D、E、F六种前四周期的元素,原子序数依次增大,A、B、C、D、E均为短周期元素,D和F元素对应的单质为日常生活中常见金属。A原子核内只有一个质子,元素A与B形成的气态化合物甲具有10e-、空间构型为三角锥形,C元素原子的最外层电子数是其电子层数的3倍,C与E同主族。下图中均含D或F元素的物质均会有图示转化关系:
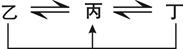
①均含D元素的乙、丙、丁微粒间的转化全为非氧化还原反应;
②均含F元素的乙(单质)、丙、丁微粒间的转化全为氧化还原反应。请回答下列问题:
(1)化合物甲的电子式为?。
(2)F元素在周期表中的位置?;稳定性:A2C ?A2E(填“大于”“小于” “等于”)。
(3)均含有D元素的乙与丁在溶液中发生反应的离子方程式?。
(4)丙、丁分别是含F元素的简单阳离子,检验含丙、丁两种离子的混合溶液中的低价离子,可以用酸性KMnO4溶液,其对应的离子方程式为:?
(5)已知常温下化合物FE的Ksp=6×10-18 mol2·L-2,常温下将1.0×10-5mol·L-1的Na2E溶液与含FSO4溶液按体积比3 :2混合,若有沉淀F E生成,则所需的FSO4的浓度要求?。(忽略混合后溶液的体积变化)。
参考答案:(12分,每空2分) (1)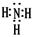 ?(2分)? (2)第四周期第Ⅷ族(2分)?大于(2分)
?(2分)? (2)第四周期第Ⅷ族(2分)?大于(2分)
(3)Al3++ 3AlO2-+6H2O=4Al(OH)3↓(2分)?(4)5Fe2++MnO4-+8H+=5Fe3++Mn2++4H2O(2分)
(5)≥2.5×10-12 mol/L(2分)(未写“≥”给1分,未写单位和其它答案不给分)
本题解析:A原子核内只有一个质子,因此A是氢元素。元素A与B形成的气态化合物甲具有10e-、空间构型为三角锥形,所以甲是氨气,B是氮元素。C元素原子的最外层电子数是其电子层数的3倍,且C的原子序数大于氮元素的,所以C是氧元素。C与E同主族,则E是S元素。D和F元素对应的单质为日常生活中常见金属,所以根据原子序数大小关系可知D是Al,F是Fe。
(1)氨气是含有共价键的共价化合物,其电子式是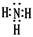 。
。
(2)铁的原子序数是26,位于元素周期表的第四周期第Ⅷ族;同主族自上而下,非金属性逐渐减弱,因此氧元素的非金属性强于S元素的非金属性。非金属性越强,氢化物的稳定性越强,因此H2O的稳定性强于H2S的稳定性。
(3)均含有Al元素的乙与丁在溶液中反应生成丙,因此丙是氢氧化铝,所以发生反应的离子方程式是Al3++ 3AlO2-+6H2O=4Al(OH)3↓。
(4)Fe2+具有还原性,能被酸性KMnO4溶液氧化,相应的离子方程式为5Fe2++MnO4-+8H+=5Fe3++Mn2++4H2O。
(5)设所需的FeSO4的浓度是x。常温下将1.0×10-5mol·L-1的Na2S溶液与含FeSO4溶液按体积比3 :2混合后S2-的浓度是1.0×10-5mol/L×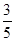 =6×10-6mol/L,Fe2+浓度是
=6×10-6mol/L,Fe2+浓度是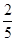 x,所以要有FeS沉淀产生,则c(Fe2+)·c(S2-) ≥Ksp=6×10-18 mol2·L-2,即6×10-6mol/L×
x,所以要有FeS沉淀产生,则c(Fe2+)·c(S2-) ≥Ksp=6×10-18 mol2·L-2,即6×10-6mol/L×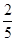 x≥6×10-18 mol2·L-2,解得x≥2.5×10-12 mol/L。
x≥6×10-18 mol2·L-2,解得x≥2.5×10-12 mol/L。
本题难度:困难
4、选择题 下列各组微粒中,半径依次增大的是 (? )
A.Al3+、Al、Mg、K
B.S、Cl、Cl-、S2-
C.Na+、Na、Cl、Cl-
D.Ca2+、K+、S2-、Cl-
参考答案:A
本题解析:考查微粒半径大小比较。同周期元素自左向右原子半径逐渐减小,同主族元素自上而下原子半径逐渐增大。同种元素阴离子半径大于原子半径大于阴离子半径。核外电子排布完全相同的微粒其微粒半径随原子序数的递增而减小。所以A正确,B中应是Cl<S,Cl-<S2-,C中Na+<Na>Cl<Cl-,D中Ca2+<K+ -<Cl-<S2-。答案A。
本题难度:一般
5、选择题 下列递变规律正确的是
A.HClO4、H2SO4、H3PO4 的酸性依次增强
B.P、S、Cl最高正价依次降低
C.钠、镁、铝的还原性依次减弱
D.HCl、HBr 、HI的稳定性依次增强
参考答案:C
本题解析:非金属性越强,最高价氧化物的水化物的酸性越强,相应氢化物的稳定性越强.A非金属位于同一周期,自左向右非金属性逐渐增强,金属性逐渐减弱,所以A不正确,C正确。元素的最高价等于元素原子的最外层电子数,B不正确。D中元素属于同一主族,自上而下非金属性逐渐减弱,相应氢化物的稳定性逐渐减弱,D不正确。答案选C。
本题难度:一般