微信搜索关注"91考试网"公众号,领30元,获取公务员、事业编、教师等考试资料40G!
1、选择题 能正确表示下列化学反应的离子方程式的是( )
A.氢氧化钡溶液与硫酸的反应?OH-+H+=H2O
B.碳酸钙溶于稀盐酸中?CaCO3+2H+=Ca2++H2O+CO2↑
C.澄清的石灰水与稀盐酸反应?Ca(OH)2+2H+=Ca2++2H2O
D.铜片插入硝酸银溶液中?Cu+Ag+=Cu2++Ag
参考答案:A.氢氧化钡溶液与硫酸的反应的离子反应为2OH-+2H++Ba2++SO42-═BaSO4↓+2H2O,故A错误;
B.碳酸钙溶于稀盐酸中的离子反应为CaCO3+2H+=Ca2++H2O+CO2↑,故B正确;
C.澄清的石灰水与稀盐酸反应的离子反应为OH-+H+=H2O,故C错误;
D.铜片插入硝酸银溶液中的离子反应为Cu+2Ag+=Cu2++2Ag,故D错误;
故选B.
本题解析:
本题难度:简单
2、实验题 某些化学反应可表示为:A+B→C+D+H2O。请回答下列问题:
(1)若A、C、D均含有氯元素,且A中氯元素的化合价介于C与D之间,则该反应的离子方程式为_________________________________。
(2)若A为黑色固体,C是黄绿色气体,则该反应的离子方程式为__________________。
(3)若A为第二周期的单质,B为第二周期某元素最高价氧化物的水化物,C、D均为气体,则该反应的化学方程式为____________________________________。
(4)若C为NaCl,D是能使澄清石灰水变浑浊的无色无味的气体,则A是______或_______,B为_____________(填化学式,下同)。
(5)若C、D均是能使澄清石灰水变浑浊的气体,则A与B的组合为_____________。
参考答案:(1) Cl2 + 2OH-= Cl-+ ClO-+ H2O(2分)
(2) MnO2 + 4H++ 2Cl-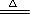 Mn2++ Cl2↑+ 2H2O(2分)
Mn2++ Cl2↑+ 2H2O(2分)
(3) C + 4HNO3(浓) 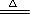 CO2↑+ 4NO2↑+ 2H2O(2分)
CO2↑+ 4NO2↑+ 2H2O(2分)
(4) Na2CO3或NaHCO3,?(2分)? HCl(2分)
(5) C与浓H2SO4(2分)
本题解析:略
本题难度:一般
3、选择题 下列离子方程式正确的是( )
A.醋酸铵和盐酸反应CH3COONH4+H+═CH3COOH+NH4+
B.氢氧化钡溶液和硫酸铜溶液反应Ba2++SO42-═BaSO4↓
C.钠与水反应Na+2H2O═Na++OH-+H2↑
D.碳酸氢钠溶液与NaOH溶液反应:HCO3-+OH-=CO32-+H2O
参考答案:A、醋酸铵和盐酸反应生成了弱电解质醋酸,反应的离子方程式为:CH3COO-+H+═CH3COOH,故A错误;
B、氢氧化钡溶液和硫酸铜溶液反应,生成了难溶物氢氧化铜和硫酸钡,反应的离子方程式为:Cu2++2OH-+Ba2++SO42-═BaSO4↓+Cu(OH)2↓,故B错误;
C、钠与水反应,离子方程式中电荷不守恒,正确的离子方程式为:2Na+2H2O═2Na++2OH-+H2↑,故C错误;
D、碳酸氢钠溶液与NaOH溶液反应生成了碳酸根离子和水,反应的离子方程式为:HCO3-+OH-=CO32-+H2O,故D正确;
故选D.
本题解析:
本题难度:简单
4、选择题 下列离子方程式正确的是(?)
A.澄清的石灰水与盐酸反应 Ca(OH) 2 + 2H+ = Ca2++ 2H2 O
B.钠与水的反应 Na + 2H2 O = Na++ 2OH- + H2↑
C.铜片插入硝酸银溶液 Cu + Ag+ = Cu2+ + Ag
D.大理石溶于盐酸 CaCO3 + 2 H+ = Ca2+ + H2O + CO2↑
参考答案:D
本题解析:A、澄清石灰水可拆,OH- + H+ = H2 O;B、不符合电荷守恒,2Na + 2H2 O? =? 2Na++ 2OH- + H2↑;C、不符合电荷守恒,Cu + 2Ag+? =? Cu2+ + 2Ag。
点评:离子方程式的书写为历年高考的重点,考生应熟记其书写规则,并灵活运用。
本题难度:简单
5、填空题 下图所示是中学化学里常见纯净物A—L间的反应关系,其中A、H、E、F为单质且E、F为气体,B在常温下是无色液体,C是淡黄色固体,L是红褐色固体。
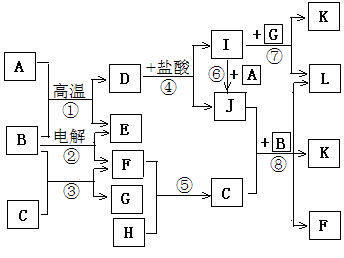
请根据图示判断并回答下列问题:
(1)单质A中所含元素在周期表中的位置是?;
(2)反应③的化学方程式为?;
(3)反应④的离子方程式为?;
(4)反应⑧的离子方程式为?;
(5)反应②发生过程中,当有3.01×1024个电子发生转移时,电解消耗物质B的质量为?g,同时阴极生成的气体的体积为?L(换算为标准状况下的体积)。
参考答案:(1)第四周期Ⅷ族(2分)
(2)2Na2O2+2H2O=4NaOH+O2↑(3分)
(3)Fe3O4+8H+=Fe2++2Fe3++4H2O(3分)
(4)4Na2O2+4Fe2++6H2O=8Na++4Fe(OH)3↓+ O2↑(3分)
(5)45(2分);56(2分)
本题解析:本题突破点在与B在常温下是无色液体,故B为谁,C为淡黄色固体,能与水反应生成G溶液与F气体单质,故C为Na2O2,G为NaOH,F为O2;L为红褐色固体,为Fe(OH)3,由D I溶液可知I为FeCl3,J为FeCl2,A为单质铁。从而可以推导出其他物质分别为:A为Fe,B为H2O,C为Na2O2,D为Fe3O4,E为H2,F为O2,G为NaOH,H为Na,I为FeCl3,J为FeCl2,K为NaCl。(1)单质A为金属Fe,在元素周期表的位置为第四周期Ⅷ族。(2)反应③为水与过氧化钠的反应,离子反应方程式为2Na2O2+2H2O=4NaOH+O2↑(3)反应④的反应为四氧化三铁和盐酸的反应,故离子反应方程式为Fe3O4+8H+=Fe2++2Fe3++4H2O。(4)反应⑧为水与过氧化钠和氯化亚铁的反应,离子反应方程式为4Na2O2+4Fe2++6H2O=8Na++4Fe(OH)3↓+ O2↑(5)反应②为电解水的反应,反应方程式为2H2O
I溶液可知I为FeCl3,J为FeCl2,A为单质铁。从而可以推导出其他物质分别为:A为Fe,B为H2O,C为Na2O2,D为Fe3O4,E为H2,F为O2,G为NaOH,H为Na,I为FeCl3,J为FeCl2,K为NaCl。(1)单质A为金属Fe,在元素周期表的位置为第四周期Ⅷ族。(2)反应③为水与过氧化钠的反应,离子反应方程式为2Na2O2+2H2O=4NaOH+O2↑(3)反应④的反应为四氧化三铁和盐酸的反应,故离子反应方程式为Fe3O4+8H+=Fe2++2Fe3++4H2O。(4)反应⑧为水与过氧化钠和氯化亚铁的反应,离子反应方程式为4Na2O2+4Fe2++6H2O=8Na++4Fe(OH)3↓+ O2↑(5)反应②为电解水的反应,反应方程式为2H2O 2H2↑+O2↑,当有3.01×1024个电子发生转移时有2.5mol水被电解,即有45g水被消耗。阴极生成的气体为氢气,且产生的氢气与电解水的物质的量相等,都为2.5mol。故转化成体积为22.4L/mol×2.5mol=56L。
2H2↑+O2↑,当有3.01×1024个电子发生转移时有2.5mol水被电解,即有45g水被消耗。阴极生成的气体为氢气,且产生的氢气与电解水的物质的量相等,都为2.5mol。故转化成体积为22.4L/mol×2.5mol=56L。
本题难度:困难