| 高考省级导航 | |
|
|
| 高考省级导航 | |
|
|
|
高中化学知识点总结《电解质和非电解质》答题技巧(2017年最新版)(八)
参考答案:(1)+1 还原剂 (2)H3PO2 本题解析:(1)据化合价代数和为0可知P化合价为+1价,P化合价由+1价+5价,故H3PO2作还原剂; 本题难度:一般 2、选择题 下列表述正确的是 |
参考答案:C
本题解析:A、次氯酸的电子式为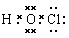 ,A错误;B、H2O与D2O均是分子,不是核素,不能互为同位素,B错误;C、乙醇与二甲醚的分子式相同均是C2H6O,但结构不同,二者互为同分异构体,C正确;D、由同一种元素形成的不同单质互为同素异形体,则CO2、CO与C不能互为同素异形体,D错误,答案选C。
,A错误;B、H2O与D2O均是分子,不是核素,不能互为同位素,B错误;C、乙醇与二甲醚的分子式相同均是C2H6O,但结构不同,二者互为同分异构体,C正确;D、由同一种元素形成的不同单质互为同素异形体,则CO2、CO与C不能互为同素异形体,D错误,答案选C。
考点:考查电子式、同位素、同素异形体以及同分异构体的判断
本题难度:一般
3、选择题 下列物质属于电解质的一组是
A.CO2、NH3、HCl
B.H2SO4、HNO3、BaCl2
C.H2SO4、H2O、Cu
D.液态KNO3、NaOH溶液、CH3CH2OH
参考答案:B
本题解析:电解质指的是在水溶液或熔融状态下都能导电的化合物。CO2、NH3不是本身导电,A错;铜是单质,C错;NaOH溶液是混合物,D错;B正确。
考点:考查电解质概念。
本题难度:一般
4、填空题 (10分)围绕下列七种物质:①铝、②A12O3、③稀硝酸、④H2SO4、⑤Ba(OH)2固体、⑥稀氨水、⑦A12(SO4)3,根据要求回答下列问题。
(1)既能与强酸反应,又能与强碱反应的是 (填序号)。
(2)属于电解质的是 (填序号)。
(3)写出最适宜制取Al(OH)3的离子方程式: 。
(4)两物质间发生反应的离子方程式为H++OH-= H2O,请写出该反应的化学方程式: 。
(5)34.2g⑦溶于水配成500mL溶液,则溶液中SO42-的物质的量浓度为 。
参考答案:(10分)
(1)①②(共2分,答对1个1分,有错不给分)
(2)②④⑤⑦(共2分,每答对2个1分,有错不给分)
(3)Al3++3NH3·H2O=Al(OH)3↓+3NH4+(2分)
(4)2HNO3+Ba(OH)2= Ba(NO3)2+2H2O(2分)
(5)0.6 mol·L-1(2分,无单位不给分)
本题解析:(1)Al既与强酸反应又与强碱反应,氧化铝是两性氧化物,既与强酸反应又与强碱反应,所以答案为①②;
(2)电解质是在熔融状态下或水溶液中导电的化合物,酸、碱、盐、水、活泼金属氧化物都是电解质,所以②④⑤⑦为电解质;
(3)氢氧化铝溶于强碱,所以不用氢氧化钠溶液与铝盐反应,而是用氨水和铝盐反应,所以最适宜制取Al(OH)3的离子方程式为Al3++3NH3·H2O=Al(OH)3↓+3NH4+;
(4)H++OH-= H2O表示强酸与强碱反应无沉淀生成,所以选择硝酸和氢氧化钡的反应,对应的化学方程式为2HNO3+Ba(OH)2= Ba(NO3)2+2H2O;
(5)34.2g⑦的物质的量是0.1mol,溶于水配成500mL溶液,则溶液的物质的量浓度是0.1mol/0.5L=0.2mol/L,所以溶液中SO42-的物质的量浓度为0.2mol/L×3=0.6mol/L。
考点:考查物质的性质、电解质、离子方程式的理解、物质的量浓度的计算等知识
本题难度:一般
5、选择题 下列物质中,属于电解质的是
A.酒精
B.铜
C.二氧化硫
D.氯化钠
参考答案:D
本题解析:电解质是指在水溶液或熔融的状态下能导电的化合物。A,C属于非电解质,B既不是电解质也不是非电解质。
考点:考查电解质概念的相关知识点
本题难度:一般
| 【大 中 小】【打印】 【繁体】 【关闭】 【返回顶部】 | |
| 下一篇:高考化学必考知识点《与量有关的.. | |