微信搜索关注"91考试网"公众号,领30元,获取公务员、事业编、教师等考试资料40G!
1、选择题 将铁铝硅合金样品分等量两份分别与足量稀盐酸和烧碱充分反应放出氢气质量相同.合金中铁铝硅质量比不可能是( )
A.112:81:28
B.336:27:84
C.324:135:36
D.56:81:56
参考答案:不管是和酸反应还是和碱反应,铝产生的氢气的量是相等的,
所以只要铁和盐酸反应产生的氢气的量与硅和氢氧化钠反应产生的氢气的量相等就行了,
2Fe~2H2
112?4
Si~2H2
28? 4
所以铁与硅的质量比为112:28=4:1,
铝的量任意,
选项中AB符合,CD不符合,
故选CD.
本题解析:
本题难度:一般
2、简答题 用含有A12O3、SiO2和少量FeO·xFe2O3的铝灰制备A12(SO4)3·18H2O。工艺流程如下:
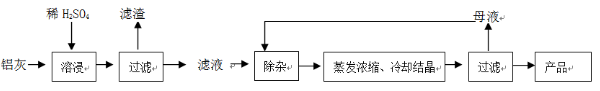 ?
?
(一定条件下,MnO4- 可与Mn2+反应生成MnO2)
已知: 生成氢氧化物沉淀的pH
?
| Al(OH)3
| Fe(OH)2
| Fe(OH)3
|
开始沉淀时
| 3.4
| 6.3
| 2.7
|
完全沉淀时
| 5.2
| 9.7
| 3.2
|
(1)H2SO4溶解A12O3的离子方程式是?;
(2)检验滤液中还存在Fe2+的方法是?(注明试剂、现象)。
(3)“除杂”环节有如下几个步骤:
(Ⅰ)向滤液中加入过量KMnO4溶液,调节溶液的pH为3.2;
(Ⅱ)加热,产生大量棕色沉淀,静置,上层溶液呈紫红色:
(Ⅲ)加入MnSO4至紫红色消失,过滤。
①步骤Ⅰ的目的?;调节溶液的pH为3.2的目的是?。
②向Ⅱ的沉淀中加入浓HCl并加热,能说明沉淀中存在MnO2的现象是?,写出其反应方程式?;
③Ⅲ中加入MnSO4的目的是?。
(4)从多次循环使用后母液中可回收的主要物质是?(填化学式)。
参考答案:(1)Al2O3+6H+=2Al3++3H2O
(2)取少量滤液,滴加KMnO4溶液,KMnO4溶液褪色
(3)①将Fe2+氧化为Fe3+;调节pH值使铁完全沉淀;
②有黄绿色气体生成;MnO2+4HCl ?MnCl2+ Cl2↑+2H2O
?MnCl2+ Cl2↑+2H2O
③除去过量的MnO4-。
(4)K2SO4。
本题解析:(1)硫酸溶解氧化铝生成硫酸铝和水,反应的离子方程式为:Al2O3+6H+=2Al3++3H2O;
(2)取少量滤液,滴加KMnO4溶液,KMnO4溶液褪色。
(3)①将Fe2+氧化为Fe3+,调节pH值使铁完全沉淀;
②加入浓盐酸与MnO2反应生成有黄绿色气体;MnO2+4HCl= MnCl2+ Cl2↑+2H2O
③MnO4-可与Mn2+反应生成MnO2,过滤除去,所以可以利用MnSO4的溶液和高锰酸钾溶液反应生成二氧化锰,把过量高锰酸根离子除去。
(4)多次循环的物质是K2SO4。
本题难度:一般
3、选择题 铝分别与足量的氢氧化钠和稀盐酸溶液反应,当两个反应放出的气体在相同状况下体积相等时,反应中消耗的NaOH和HCl物质的量之比为( )
A.2:1
B.3:1
C.1:1
D.1:3
参考答案:令生成的氢气的物质的量为3mol,则:
? 2Al+6HCl=2AlCl3+3H2↑,
?6mol? 3mol
2Al+2NaOH+2H2O=2NaAlO2+3H2↑
? 2mol?3mol
所以所取氢氧化钠和盐酸溶液中NaOH、HCl的物质的量的之比为2mol:6mol=1:3;
故选D.
本题解析:
本题难度:简单
4、选择题 常温下能用铝制容器盛放的是( )
A.稀硫酸
B.氢氧化钠溶液
C.浓硫酸
D.硫酸铜溶液
参考答案:A、稀硫酸是弱氧化性的酸,能和铝反应生成氢气,不能用铝制品容器盛放,故A错误;
B、铝与氢氧化钠溶液反应生成偏铝酸钠与氢气,不能用铝制品容器盛放,故B错误;
C、铝在浓硫酸中发生钝化现象,故铝制品容器可以盛放浓硫酸,故C正确;
D、铝与硫酸铜溶液反应置换出Cu,故D错误.
故选C.
本题解析:
本题难度:简单
5、选择题 下列实验过程中产生沉淀的物质的量(Y) 与加入试剂的量(X)之间的关系正确的是?

A.向AlCl3溶液中逐滴加入NaOH溶液至过量且边滴边振荡
B.向NaAlO2溶液中滴加稀盐酸至过量且边滴边振荡
C.向NH4Al(SO4)2溶液中逐滴加入氢氧化钠溶液直至过量
D.向NaOH、Ba(OH)2、NaA1O2的混合溶液中逐渐通入二氧化碳至过量
参考答案:C
本题解析:本题利用1mol法,即往什么溶液中加就设谁为1mol,A、设AlCl3为1mol,产生1molAl(OH)3时消耗3mol的NaOH,再加NaOH,发生Al(OH)3+NaOH=Na[Al(OH)4],消耗1molNaOH,所以沉淀量最大前后NaOH的物质的量之比为3:1。B、向NaAlO2溶液中滴加稀盐酸应该先产生沉淀。C、设NH4Al(SO4)2为1mol,加入NaOH,先和Al3+反应消耗3mol NaOH生成1mol的Al(OH)3,然后NH4+和NaOH反应消耗1mol的NaOH,沉淀量保持不变,继续加NaOH,1mol的Al(OH)3溶解消耗1mol的NaOH,故C正确。D、向NaOH、Ba(OH)2、NaAlO2的混合溶液中逐渐通入二氧化碳至过量,依次发生的反应为CO2+ Ba(OH)2= BaCO3+H2O,CO2+2NaOH= Na2CO3+ H2O,[Al(OH)4]-+ CO2=HCO3-+ Al(OH)3,CO32-+H2O+CO2=2HCO3-,BaCO3+H2O+CO2= Ba(HCO3)2故图像错误。3图像判断
本题难度:一般