微信搜索关注"91考试网"公众号,领30元,获取公务员、事业编、教师等考试资料40G!
1、选择题 蛇纹石矿可看作由MgO、Fe2O3、Al2O3、SiO2组成。由蛇纹石制碱式碳酸镁的实验步骤如下:?
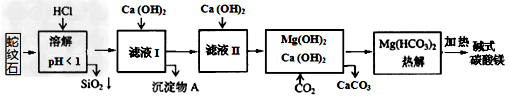
室温下,相关金属氢氧化物沉淀的KSP见下表1
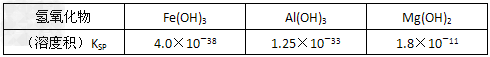
注:①?lg2=0.3,②离子的浓度小于1.0×10-5?mol·L-1时?,可认为该离子沉淀完全。下列说法不正确的是
[? ?]
A.在滤液I中,不能加过量的Ca(OH)2是为了防止Al(OH)3溶解和Mg2+沉淀
B.滤液I中,加Ca(OH)2后Al3+比Fe3+先沉淀完全
C.室温下,用Ca(OH)2把滤液I的pH调节到4.7时,Al3+刚好沉淀完全
D.称18.2g碱式碳酸镁【aMgCO3·b?Mg(OH)2·cH2O】高温加热分解得到6.6g?CO2和8.0g?MgO,由此可知a=3、b=1、c=3
参考答案:B
本题解析:
本题难度:一般
2、实验题 设计实验探讨向AlCl3溶液中加入过量的NaOH和向NaOH溶液中加入过量的AlCl3现象是否一样。_________________________________
参考答案:向AlCl3溶液中逐滴加入NaOH有白色沉淀生成,当NaOH过量时沉淀溶解,最后生成物为NaAlO2。反应的离子方程式为:Al3++3OH-==Al(OH)3↓,Al(OH)3+OH-==?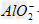 +2H2O
+2H2O
向NaOH溶液中逐滴加入AlCl3溶液时,观察到的现象是:开始有白色沉淀生成,振荡后立即消失,继续滴加AlCl3溶液直至过量时,又出现白色沉淀,且不消失。这是因为反应开始时,由于NaOH溶液过量,滴入的AlCl3和NaOH作用转化为NaAlO2,当加入过量AlCl3时,AlCl3和NaAlO2在溶液里发生反应,生成沉淀Al(OH)3。其反应的离子方程式为:Al3++3OH-====Al(OH)3↓,Al(OH)3+OH-==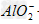 +2H2O,Al3++3
+2H2O,Al3++3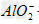 +6H2O==4Al(OH)3↓
+6H2O==4Al(OH)3↓
综上所述,二者滴加顺序不同,现象不一样。
本题解析:
本题难度:一般
3、选择题 下列反应中,调节反应物用量或浓度不会改变反应产物的是
[? ]
A.CO2通入石灰水
B.AlCl3溶液中滴入NaOH溶液
C.硫酸中加入锌粉
D.HCl溶液滴入NaHCO3溶液
参考答案:D
本题解析:
本题难度:简单
4、选择题 已知,Fe2+结合S2-的能力大于结合OH-的能力,而Al3+则正好相反。在Fe2(SO4)3和AlCl3的混合溶液中,先加入过量的KI溶液,再加入足量的Na2S溶液,所得沉淀是
[? ]
A.Al2S3、FeS和S
B.Fe(OH)3和Al(OH)3
C.Fe2S3和Al(OH)3
D.FeS、Al(OH)3和S
参考答案:D
本题解析:
本题难度:一般
5、选择题 实验室中,要使AlCl3溶液中的Al3+全部沉淀出来,适宜用的试剂是
[? ]
A.NaOH溶液
B.Ba(OH)2溶液
C.盐酸
D.氨水
参考答案:D
本题解析:
本题难度:简单